Introduction
La douleur est un symptôme habituel de la pathologie cancéreuse, concernant environ 90 % des patients au cours de leur maladie. La prise en charge adéquate et optimale de la douleur est donc primordiale pour optimiser leur qualité de vie puisque 50 % des patients à des stades avancés présenteront des douleurs modérées à sévères. Dans la pathologie cancéreuse, la douleur est causée soit par une lésion tissulaire (douleurs nociceptives), soit par une lésion ou un dysfonctionnement du système nerveux (douleurs neuropathiques). Le site préférentiel métastatique est le rachis dans 30 à 70 % des cas. Parmi les thérapies dites non médicales, la radiothérapie permettrait une réduction des douleurs dans un quart à un tiers des cas. Néanmoins, cette technique nécessite d’attendre plusieurs semaines avant l’atténuation de la douleur. De plus, sa radiosensibilité diffère selon l’histologie du primitif et les contraintes de limitation de la dose empêchent de traiter à nouveau la zone douloureuse en cas d’inefficacité. En outre, la radiologie interventionnelle est devenue l’une des options thérapeutiques mini-invasives pour soulager les patients de manière efficace et rapide (dès la première semaine généralement) voire envisager un contrôle tumoral local pour les patients oligométastatiques. Cet article fait le point sur les différentes techniques percutanées et/ou endovasculaires qui peuvent entrer dans l’arsenal thérapeutique antalgique lorsque les traitements médicaux sont insuffisants.
Neurolyse percutanée
La neurolyse percutanée consiste en la destruction des fibres nerveuses envahies ou lésées par la tumeur de façon chimique ou thermique. Les indications de la neurolyse percutanée en oncologie sont les douleurs viscérales nociceptives ou les douleurs neuropathiques liées à l’envahissement de structures nerveuses (système sympathique) résistant aux antalgiques de pallier III. Ces douleurs sont généralement le fait de cancers « viscéraux » (pancréas, surrénale, colon) ou envahissant les plexus nerveux sympathiques. La neurolyse peut être réalisée à différents niveaux en fonction de la localisation des douleurs : ganglion stellaire (douleurs des membres supérieurs en rapport avec un syndrome de Pancoast-Tobias ou des cancers ORL), plexus cœliaque (douleurs épigastriques en rapport avec des cancers gastriques, pancréatiques ou biliodigestifs), plexus lombaire (douleurs des membres inférieurs), plexus hypogastrique et ganglion impar (douleurs pelviennes ou périnéales en rapport avec une chirurgie ou une radiothérapie pelvienne).
Neurolyse chimique
Décrite pour la première fois en 1957, la neurolyse chimique consiste en la destruction des fibres nerveuses sympathiques par un agent neurolytique : l’alcool ou le phénol. La procédure est réalisée sous anesthésie locale et guidage scanographique, ou plus rarement fluoroscopique. Le patient est positionné en décubitus (ganglion stellaire) ou en procubitus (plexus cœliaque, plexus lombaire, plexus hypogastrique, ganglion impar). Le geste consiste en la mise en place d’aiguilles spinales 22 gauges (G) au contact des plexus nerveux sympathiques (tiers antérieur du corps vertébral), par voie antérolatérale (ganglion stellaire) ou postérolatérale (plexus cœliaque, plexus lombaire, plexus hypogastrique, ganglion impar).
5 cm3 de Xilocaïne puis d’alcool absolu
La bonne position des aiguilles est vérifiée par l’injection de 3 cm3 (ml) de produit de contraste iodé (diffusion du produit de contraste à la partie antérieure du corps vertébral) ; cette injection d’iode prédit également la diffusion de l’alcool (non radio-opaque).
Si les aiguilles sont correctement positionnées, on procède à l’injection de 5 cm3 d’adrénaline tartrate + lidocaïne chlorhydrate monohydrate (Xylocaïne) suivie de l’injection de 5 cm3 d’alcool absolu. L’alcool est habituellement préféré au phénol en raison d’un bloc nerveux prolongé. Un scanner de contrôle en fin de procédure montre la répartition de l’alcool au sein du produit de contraste. Le patient devra être informé du risque d’hypotension et de la survenue possible de nausées et/ou de vomissements au décours de la procédure.
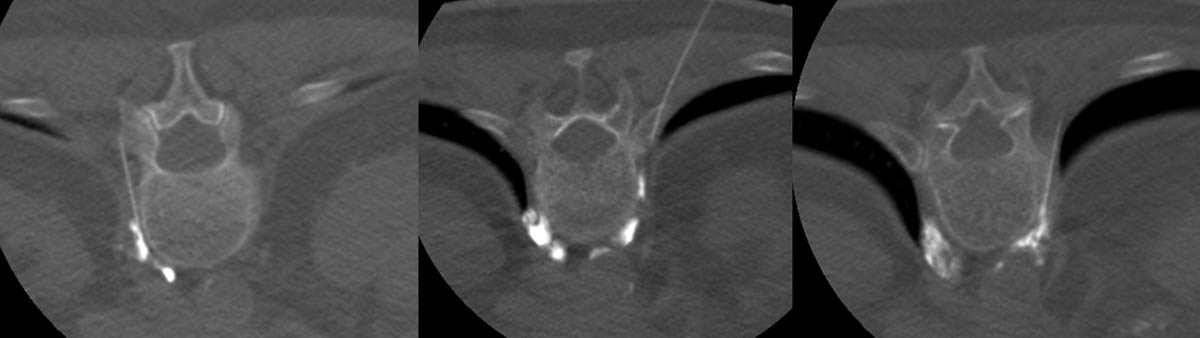
Figure 1. Alcoolisation du plexus cœliaque sous guidage scanographique à l’étage T12-L1. Injection de produit de contraste iodé diffusant aux 2/3 antérieurs du corps vertébral de T12 (A, B). Injection d’alcool absolu entraînant une dilution du produit de contraste iodé précédemment injecté (C). © Weiss J. et coll.
Neurolyse thermique
La neurolyse thermique consiste en la destruction par le froid (cryothérapie) ou par le chaud (radiofréquence) de la portion tumorale envahissant les structures nerveuses adjacentes. Cette technique a l’avantage d’offrir un meilleur contrôle de la zone de neurolyse, notamment en cryothérapie, grâce à la bonne visualisation du glaçon. Ce type de procédure est le plus souvent réalisé sous anesthésie générale, l’intervention étant plus longue et plus douloureuse. On utilisera un guidage scanographique ou remnographique pour la mise en place des sondes de cryothérapie ou de radiofréquence. Le type et le nombre de sondes dépendront essentiellement de la taille de la lésion à traiter et du caractère curatif ou palliatif du traitement.
Ablation percutanée
L’une des principales causes de douleurs en oncologie est le plus souvent l’atteinte métastatique osseuse, préférentiellement rachidienne dorsolombaire (70 % des cas), pelvienne ou fémorale. Différentes techniques d’ablation percutanée sont utilisées pour agir localement sur la tumeur : laser, radiofréquence ou cryothérapie. La réduction de la douleur par ces méthodes résulte de plusieurs phénomènes physiopathologiques : destruction des fibres nerveuses à l’interface entre la tumeur et le périoste ou l’endoste, inhibition de l’activité ostéoclastique, diminution du relargage de cytokines inflammatoires par la tumeur, décompression tumorale.
Palliative ou curative
On distinguera deux types d’indications à ces ablations thermiques percutanées : palliative quand le but du traitement est uniquement la diminution des douleurs, curative lorsque l’objectif du traitement est à la fois une diminution des douleurs et un contrôle tumoral local (patients oligométastatiques). Ces méthodes entrent généralement dans la prise en charge antalgique du patient lorsque les traitements médicaux sont devenus insuffisants, la plupart du temps après discussion du dossier lors d’une réunion de concertation pluridisciplinaire. Le choix de la technique d’ablation dépendra principalement de la localisation de la tumeur, de sa taille, de l’indication, des disponibilités matérielles locales et de l’expérience de l’opérateur.
Efficaces, fiables et reproductibles
Par rapport à la radiofréquence, la cryothérapie a l’avantage de permettre des tailles d’ablation plus larges grâce à l’utilisation simultanée de plusieurs sondes, la visualisation du glaçon et donc des limites d’ablation, et une réduction des douleurs per et postopératoires. Ses inconvénients sont le coût et la durée d’intervention. Ces méthodes sont des techniques efficaces, fiables et reproductibles, mini-invasives et entraînant peu de complications.
Guidage par scanner ou IRM
Le type d’anesthésie dépendra du patient, du volume tumoral à traiter, de la technique d’ablation et de l’expérience du radiologue et/ou de l’anesthésiste. Dans la plupart des cas, ces procédures nécessitent une sédation consciente ou une anesthésie générale, notamment lors de l’ablation de larges volumes tumoraux ou de lésions proches de structures à risque. Ces traitements consistent en la mise en place de sondes ou applicateurs sous guidage scanographique ou remnographique. Le type et le nombre de sondes dépendront essentiellement de la taille de la lésion à traiter et du caractère curatif ou palliatif du traitement.
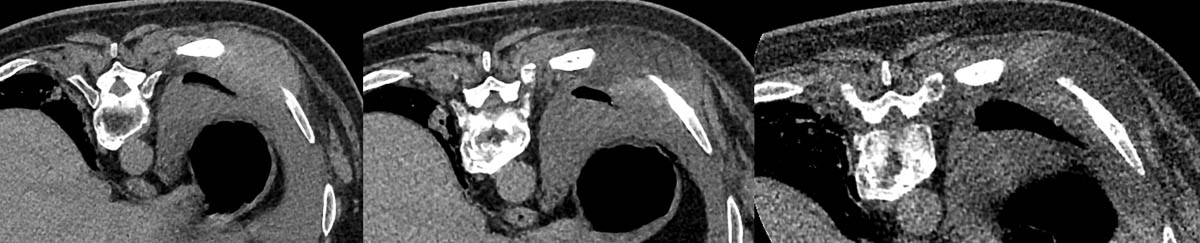
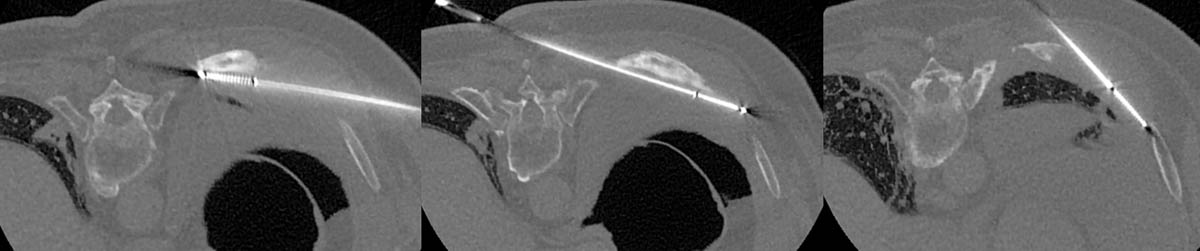
Figure 2. Cryothérapie d’une volumineuse lésion secondaire pariétale thoracique droite envahissant l’espace intercostal (A). Bonne visualisation du glaçon correspondant à la zone hypodense au scanner (B, C). Mise en place des sondes sous contrôle scanographique (D, E, F). © Weiss J. et coll.
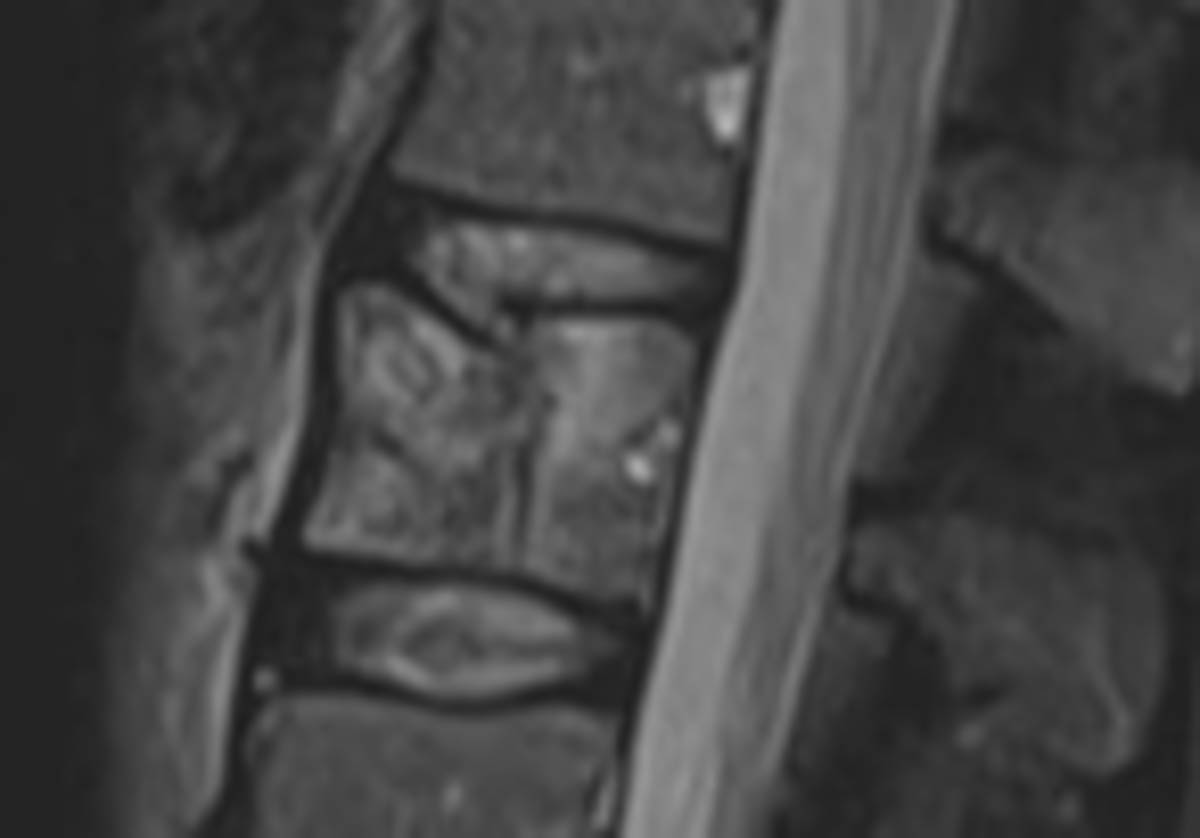
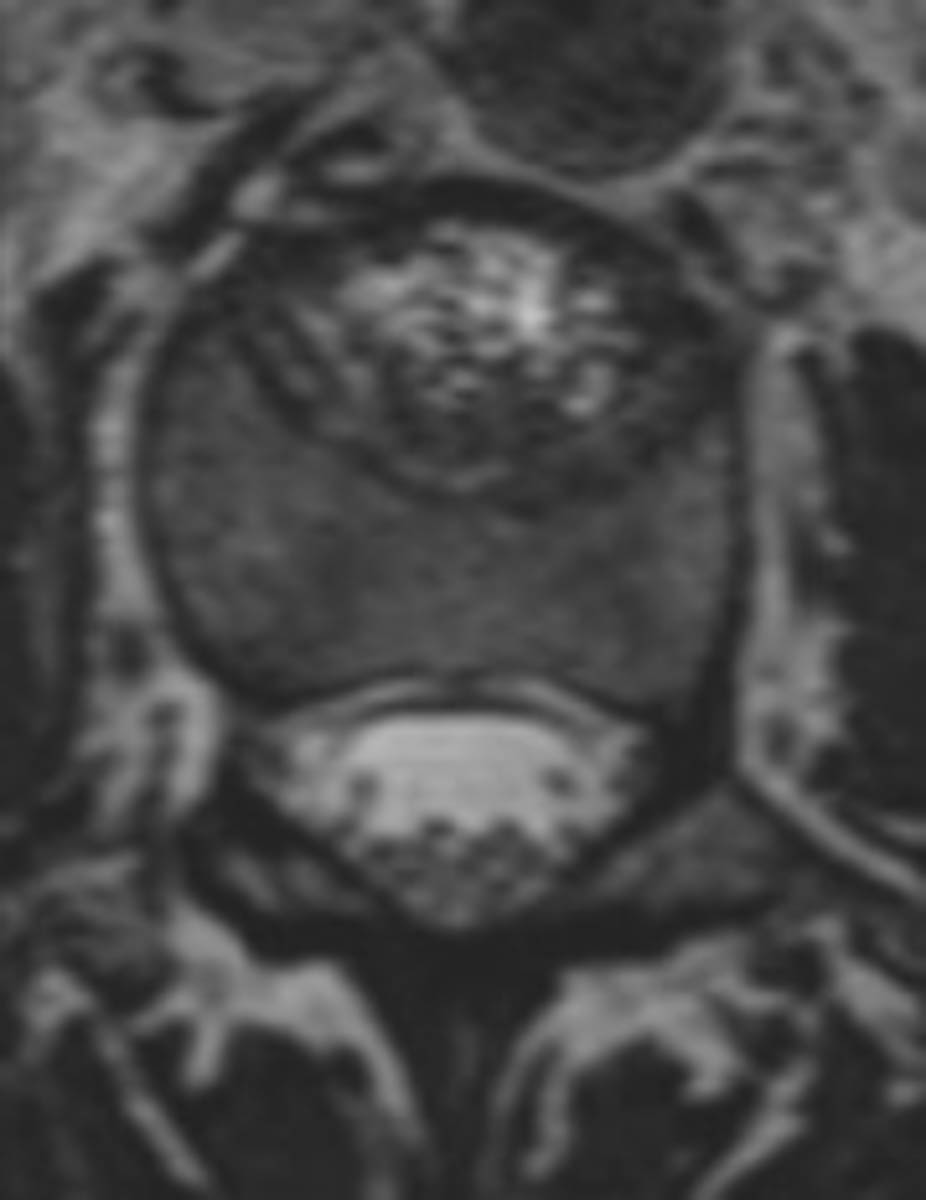
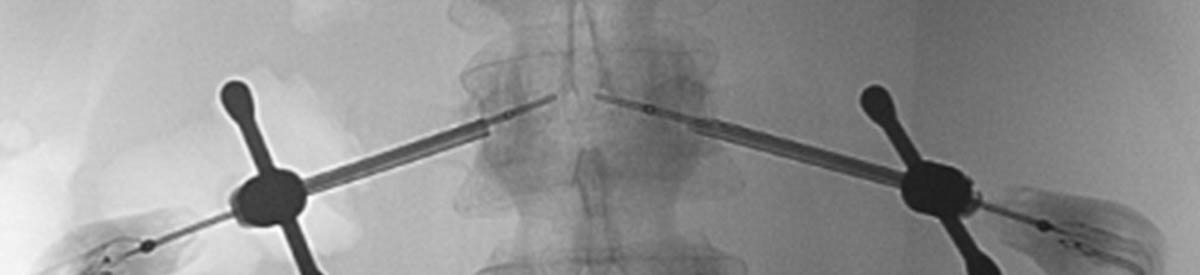
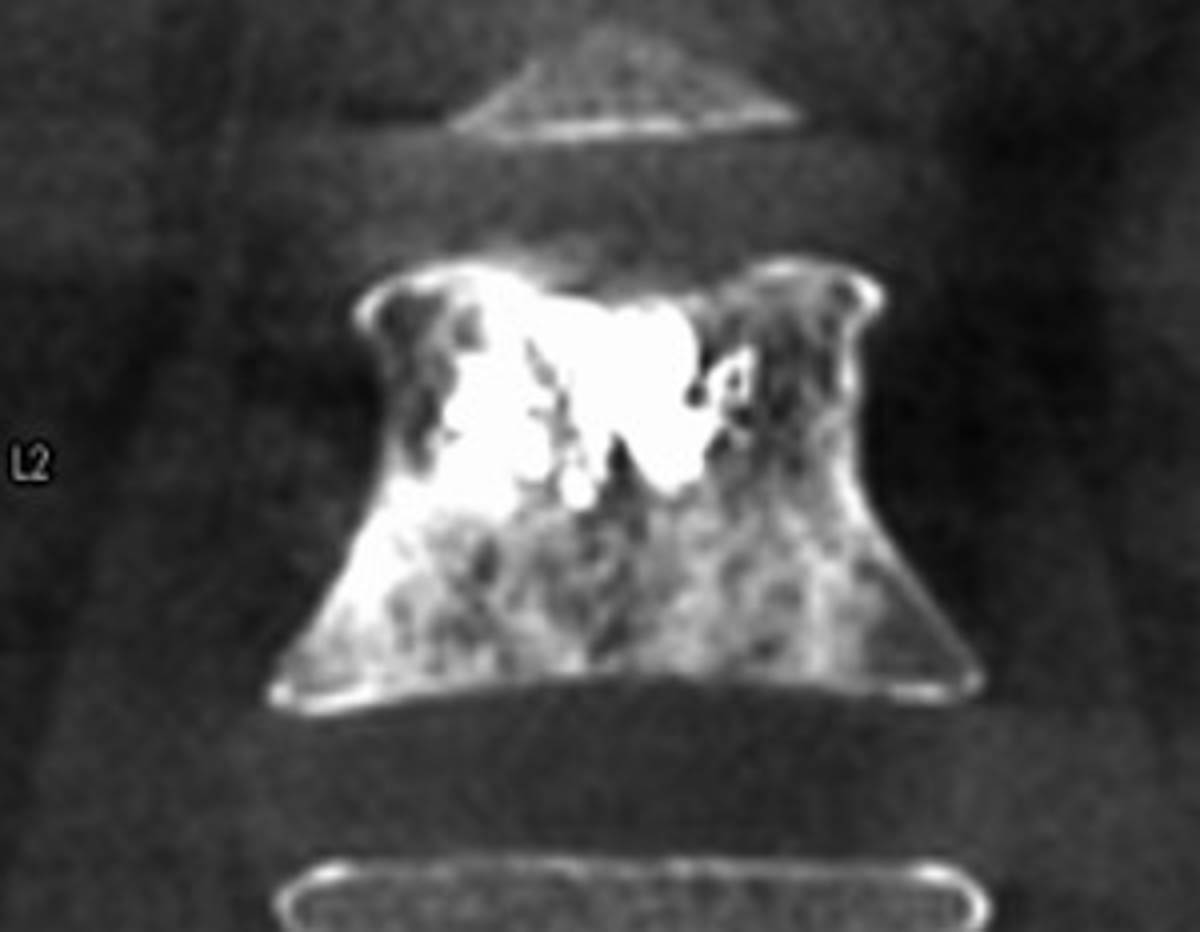
Figure 3. Radiofréquence bipolaire d’une lésion secondaire de L3 avec fracture pathologique (A, B). Mise en place des sondes de radiofréquence sous contrôle fluoroscopique de façon coaxiale (C). Contrôle scanographique après thermoablation de la lésion et cimentoplastie de L3 (D). © Weiss J. et coll.
Cimentoplastie
La cimentoplastie consiste en l’injection de ciment acrylique (PMMA) au sein de lésions ostéolytiques du squelette axial ou périphérique douloureuses et/ou fragilisantes. Le ciment injecté n’a aucun effet antitumoral ; utilisée seule, cette technique sera donc plutôt indiquée dans la prise en charge palliative de lésions ostéolytiques multiples. Chez les patients oligométastatiques, cette méthode pourra être couplée à une technique d’ablation percutanée (cryothérapie ou radiofréquence) pour obtenir un contrôle local en plus de la consolidation à but antalgique.
L’intervention est réalisée sous sédation consciente ou anesthésie générale en fonction du nombre de lésions à traiter, de leur localisation et de la durée prévisible d’intervention. Le guidage sera généralement fluoroscopique pour les vertébroplasties thoraciques basses (en dessous de T4) et lombaires ou les sacroplasties, et scanographique pour les autres localisations.
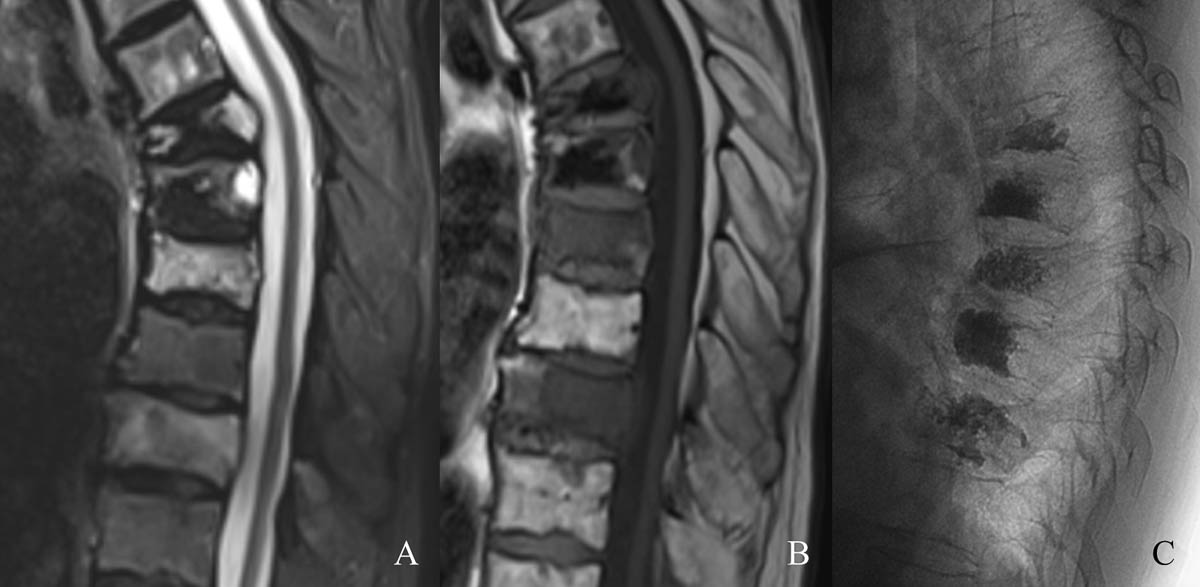
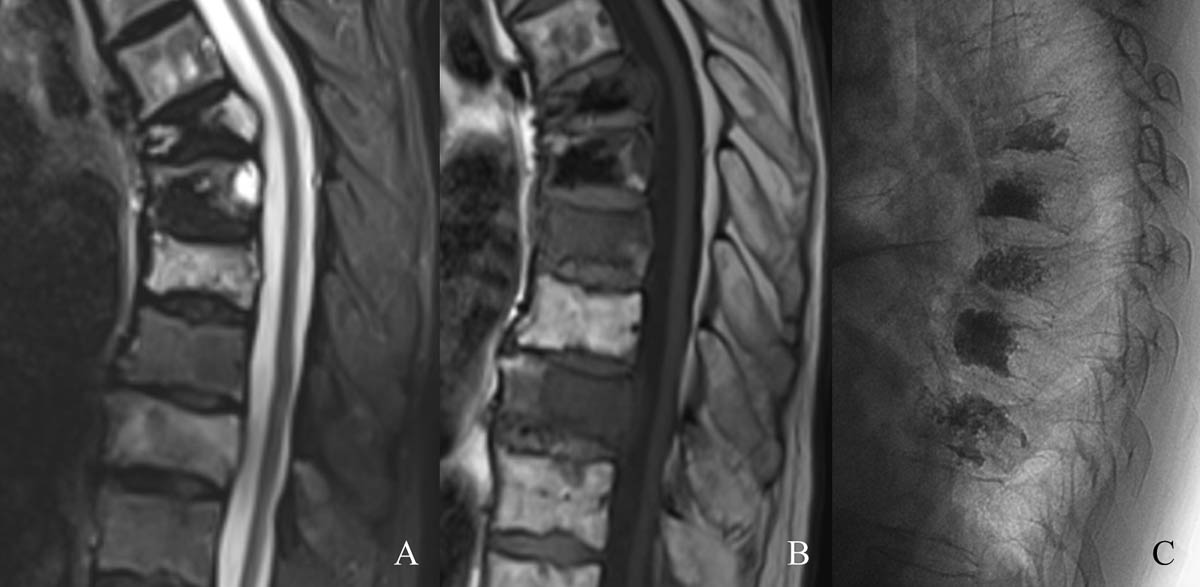
Figure 4. Fractures pathologiques de T8 et T10 dans le cadre d’un myélome en hypersignal STIR (A) et hyposignal T1 à l’IRM (B). Cimentoplastie sous contrôle fluoroscopique (C). © Weiss J. et coll.
Vissage
Le vissage percutané consiste en une stabilisation des fractures pathologiques du squelette périphérique douloureuses et/ou instables. De la même façon que la cimentoplastie seule, cette méthode n’a pas d’effet antitumoral. Elle pourra cependant être couplée à une cimentoplastie pour renforcer la consolidation ou à une technique d’ablation percutanée chez les patients oligométastatiques.
L’intervention est réalisée de préférence sous anesthésie générale. La mise en place des vis se fera sous guidage fluoroscopique ou scanographique. Il sera important de vérifier la persistance d’os « sain » en amont et en aval de la fracture afin d’assurer un ancrage correct de la vis. L’utilisation de vis perforées permettant l’injection simultanée de ciment est une autre manière de renforcer l’ancrage de ces dernières. La longueur et le nombre de vis dépendront de la localisation de la fracture et de l’étendue de la lyse.
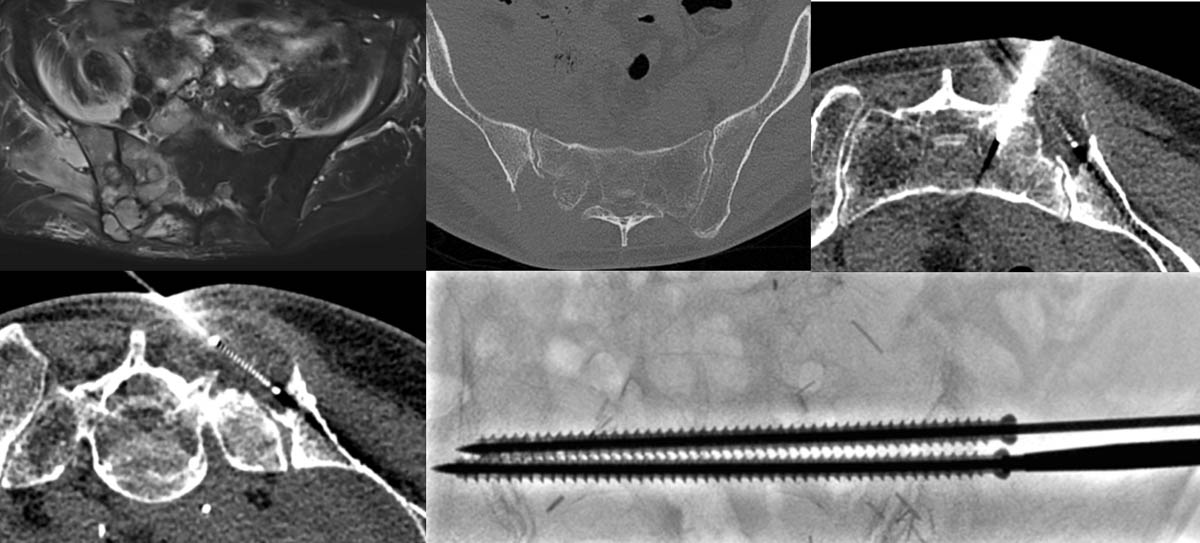
Figure 5. Lésion secondaire douloureuse centrée sur l’articulation sacro-iliaque droite (A, B). Cryothérapie de la portion iliaque sous contrôle scanographique (C, D). Vissage de l’articulation sous contrôle scopique et scanographique (E). © Weiss J. et coll.
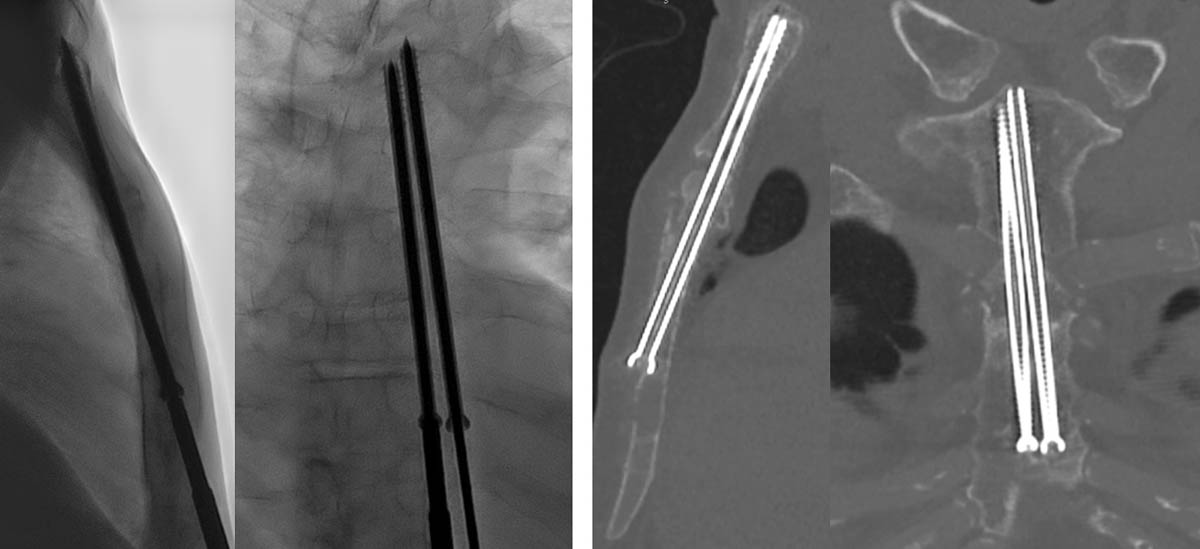
Figure 6. Vissage percutané sous contrôle fluoroscopique d’une fracture pathologique du corps du sternum sur myélome (A, B). Contrôle scanographique montrant une stabilisation de la fracture par les vis (C, D). © Weiss J. et coll.
Embolisation
L’embolisation tumorale par voie endovasculaire dans la pathologie cancéreuse est le plus souvent indiquée pour des lésions ostéolytiques du squelette axial ou périphérique secondaires d’une tumeur hypervasculaire (rein, thyroïde) douloureuses et/ou fragilisantes. La réduction de la douleur par cette méthode résulte d’une ischémie tumorale entraînant une inhibition de la croissance tumorale, une réduction de l’effet de masse sur les structures adjacentes et une réduction du risque fracturaire. Elle peut être indiquée en préopératoire à visée curative ou dans les prises en charge palliatives. L’inconvénient de cette technique est la récurrence tumorale après traitement. C’est pourquoi elle est en général couplée à une autre méthode d’ablation et à une consolidation si nécessaire.
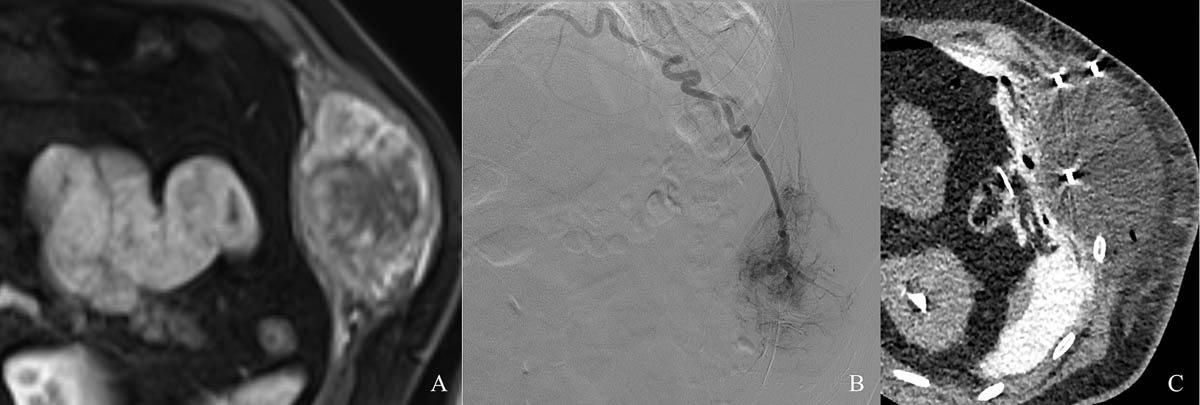
Figure 7. Volumineuse lésion costale gauche hypervasculaire secondaire d’un cancer du rein (A). Embolisation de la lésion (B) avant cryothérapie sous contrôle scanographique (C). © Weiss J. et coll.
Conclusion
La gestion optimale de la douleur est la pierre angulaire de la prise en charge du patient oncologique pour permettre une amélioration de sa qualité de vie. Les techniques de radiologie interventionnelle, mini-invasives, ont intégré depuis quelques années l’arsenal thérapeutique antalgique pour cette catégorie de patients, permettant une augmentation de leur qualité de vie, une diminution de la morbidité voire un contrôle tumoral local. Les différentes techniques percutanées décrites se répartissent entre les méthodes de consolidation et d’ablation. Dans la plupart des cas, on choisira d’allier deux de ces méthodes, notamment pour les patients oligométastatiques.











Discussion
Aucun commentaire
Commenter cet article