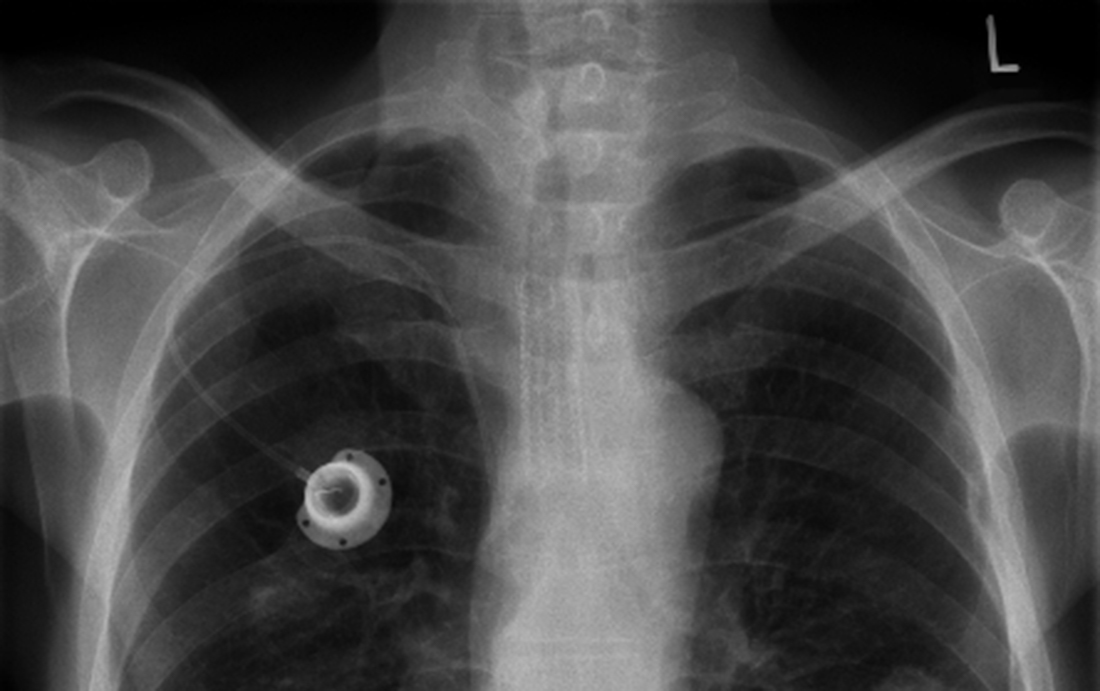
La Food & Drug Administration (FDA) appelle les usagers d’IRM à la prudence. L’organisme de sécurité des médicaments des États-Unis a en effet recensé plusieurs cas de dysfonctionnements de cathéters implantables chez des patients qui venaient d’être soumis à des champs magnétiques. Parmi ceux-ci, des variations de doses de produits injectés et des problèmes mécaniques, dont certains ont entraîné la mort des porteurs.
Peser les bénéfices et les risques
Le 11 janvier 2017, la FDA a donc émis une série de recommandations à destination des patients et des professionnels des cabinets et services d’imagerie médicale. Aux radiologues, elle demande notamment de bien analyser les bénéfices et les risques de l’examen d’IRM pour chaque patient, et rappelle l’importance de vérifier que le dispositif implantable est IRM compatible à 1,5 ou 3 T, si besoin en contactant le fabricant pour lever tous les doutes.
Suivre le patient avant, pendant et après l’examen
Aux manips, la FDA rappelle qu’ils doivent









Discussion
Aucun commentaire
Commenter cet article