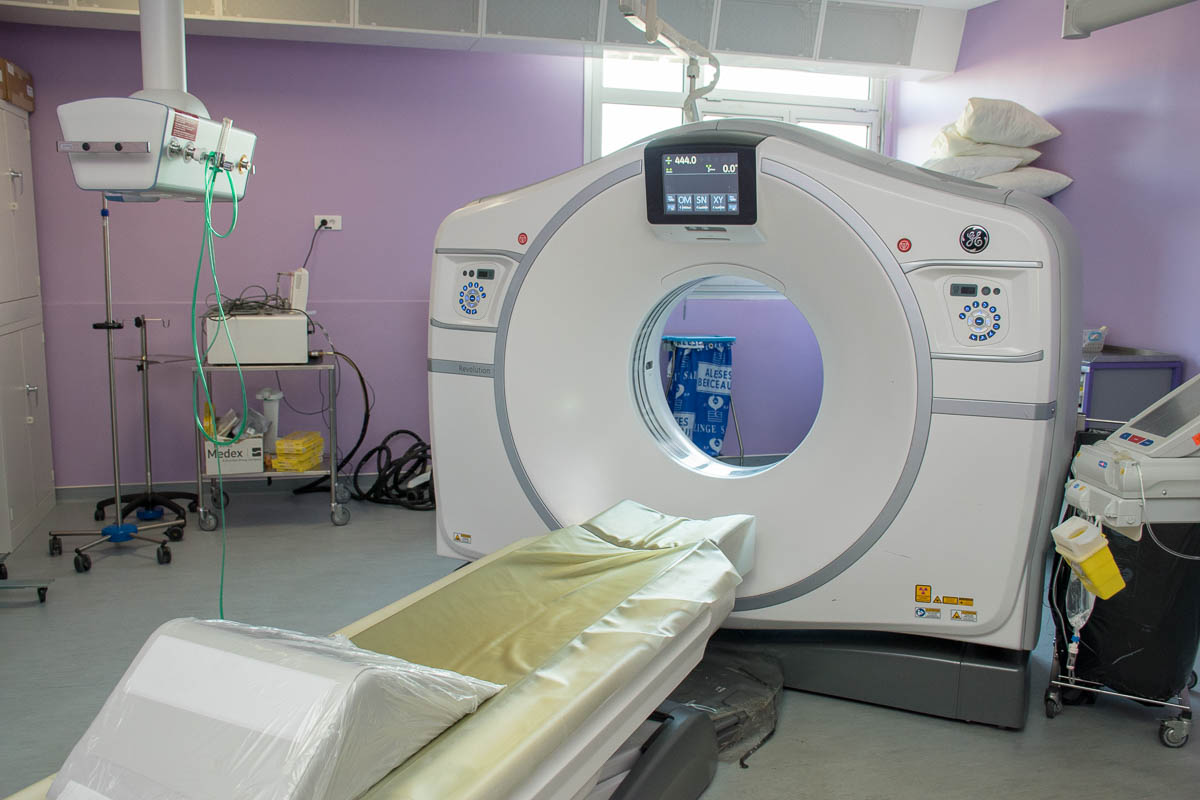
Entré en vigueur en 2017, le règlement européen 2017/745 sur les dispositifs médicaux (DM) doit être appliqué à parti du 26 mai 2020. Il précise et crée des dispositions concernant l’évaluation des produits avant leur mise sur le marché et leur surveillance après leur mise sur le marché et doit permettre de renforcer la sécurité et la transparence pour le grand public.
Un règlement dans la continuité
« Ce texte est la continuité d’une réglementation qui existe déjà et qui est régie par la directive européenne 93/42/CEE pour le marquage CE médical. Nous changeons de système réglementaire en passant d’une directive transposée à un règlement qui est d’application directe », explique Cécile Vaugelade, directrice des affaires réglementaires du Syndicat national de l'industrie des technologies médicales (SNITEM).
Le texte triple de volume
Le règlement, qui entrera en application l’année prochaine, ne bouleversera pas l’encadrement des dispositifs médicaux. Cependant, il étoffe et détaille les cr







Discussion
Aucun commentaire
Commenter cet article