Malformation artérioveineuse (MAV) versus fistule durale (FD)
Une connexion directe entre les artères et les veines
Parmi les pathologies strictement vasculaires intracrâniennes, on retrouve les anomalies des artères (syndrome de Moya Moya), des veines (anomalie veineuse de développement, télangiectasie), des capillaires (cavernome), et, d’autre part, les pathologies dites « avec shunt » que sont les malformations artérioveineuses (MAV) et les fistules durales (FD). Dans ces deux derniers cas, il s’agit d’une connexion directe entre les artères et les veines, sans interposition de lit capillaire normal.
La MAV est congénitale
Une MAV (figure 1) est une malformation vasculaire congénitale, non héréditaire, au sein de laquelle il existe un « nidus » entre la ou les artères afférentes, et la ou les veines efférentes, sans interposition de lit capillaire. Sa prévalence est estimée jusqu’à environ 0,6 % de la population générale [1]. Son diagnostic se fait le plus fréquemment chez l’adulte jeune, l’âge moyen au diagnostic étant de 32 ans.
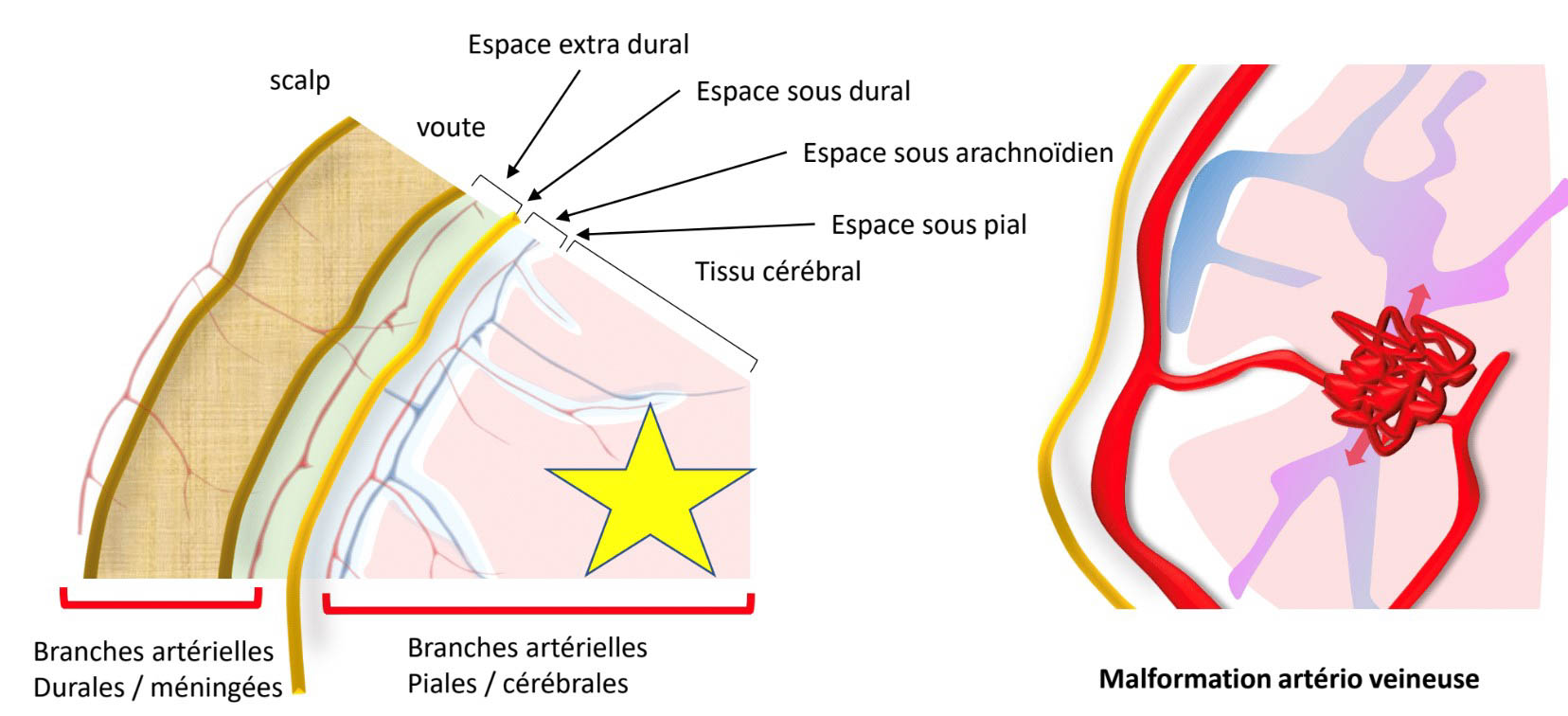
Figure 1. Schéma représentatif d’une malformation intracrânienne. Une MAV est intra-parenchymateuse (étoile jaune et bleue), alimentée par des branches essentiellement piales et cérébrales, et se draine dans une ou plusieurs veines cérébrales.© Héloïse Ifergan
La fistule durale est acquise
Une fistule durale (figure 2) est une pathologie acquise. Elle intéresse 10 à 15 % des malformations vasculaires intracrâniennes [2]. Il s’agit d’une communication directe, sans lit capillaire et sans nidus, entre une artère et un sinus dural ou une veine intracrânienne située à proximité d’un sinus dural. Les FD peuvent survenir après un traumatisme, une chirurgie, ou une sténose veineuse. Les fistules durales sont d’autre part intimement liées aux thromboses veineuses, sans que l’on parvienne à trancher entre cause ou conséquence entre ces deux pathologies [3]. On peut aussi ne pas retrouver de cause à ces fistules (idiopathiques).
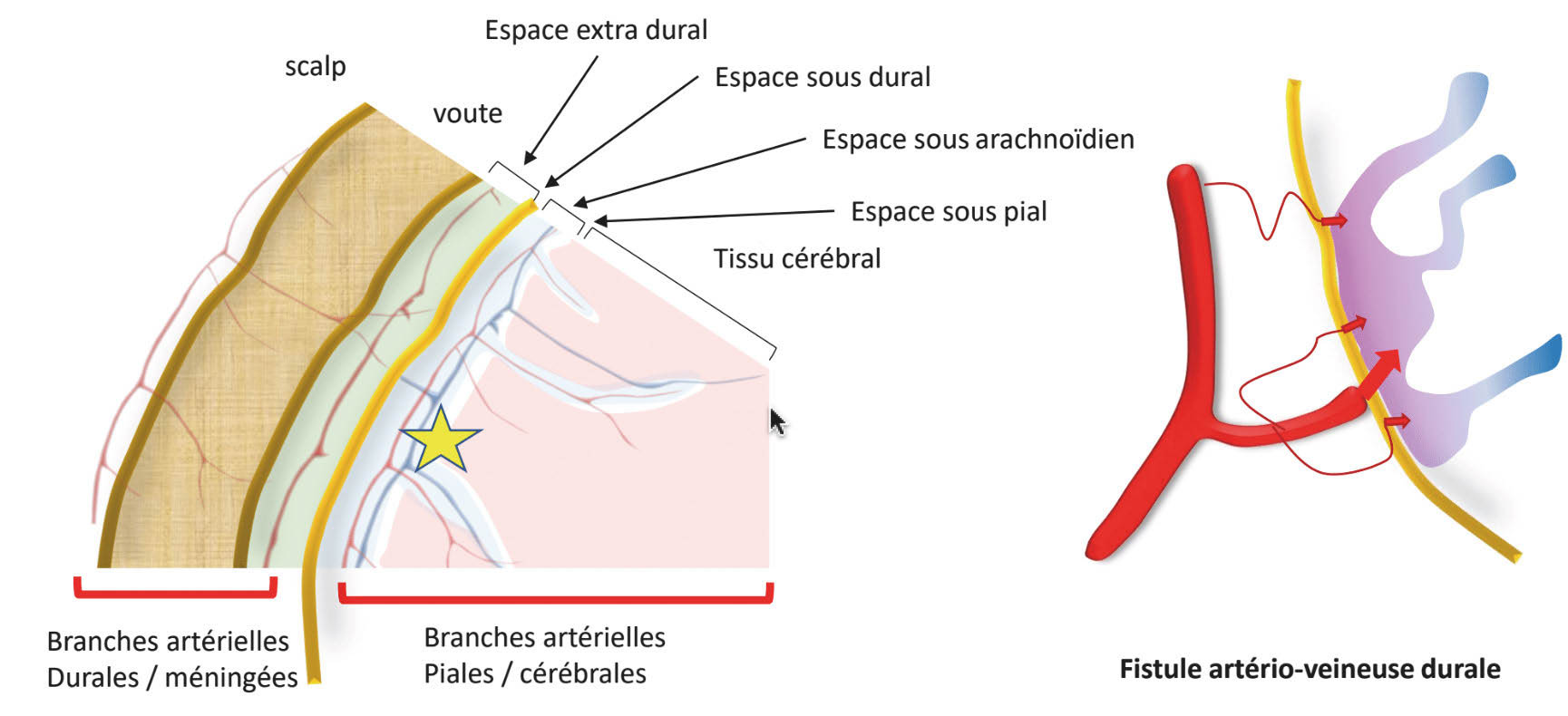
Figure 2. Schéma représentatif d’une fistule durale. Une fistule durale est alimentée par des vaisseaux à destinée durale (essentiellement méningés), et se situe dans l’espace sous-dural (étoile jaune et bleue).© Héloïse Ifergan
Les malformations de la veine de Galien
Les malformations de la veine de Galien sont des shunts intracrâniens congénitaux, rares (≤ 1 des malformations vasculaires intracrâniennes). Le shunt est médian, les artères afférentes sont multiples, et dominées le plus fréquemment par les artères choroïdiennes, avec un drainage se faisant majoritairement dans une veine de Galien dilatée.
La présentation de la pathologie peut se faire par une insuffisance cardiaque, une hydrocéphalie avec un élargissement du périmètre crânien, des céphalées, ou un retard psychomoteur en fonction de l’âge de dépistage de la pathologie. Néanmoins, dans la majorité des cas, le diagnostic est réalisé durant la période anténatale. Cette pathologie de l’enfant ne sera pas plus développée dans cet article.
Malformation artérioveineuse
Modes de présentation clinique
La malformation apparaît durant le développement fœtal, elle est néanmoins rarement dépistée in utero. Cette malformation continuerait probablement à croître après la naissance [4].
Les MAV multiples sont rares (9 %) et peuvent être associées au HHT (Hereditary Hemorrhagic Telangiectasia ou syndrome de Rendu-Osler). La plupart des cas sont sporadiques, les MAV familiales étant exceptionnelles. Il existe par ailleurs des syndromes où la MAV intracrânienne s’intègre dans une pathologie plus complexe dite métamérique.
20 % des MAV sont asymptomatiques au moment du diagnostic.
Autrement, le mode de révélation le plus fréquent – près de la moitié des cas – est l’hémorragie intracrânienne [5].
C’est aussi son évolution la plus grave : lorsqu’une MAV n’est pas rompue, on estime que son risque de premier épisode hémorragique est de 2 à 4 % par an ; lorsqu’elle s’est rompue une première fois, son risque de seconde rupture augmente alors entre 7 et 18 % par an, et ce risque revient à celui d’une MAV non rompue au bout de 3 à 5 ans [4, 6].
Les crises convulsives (20 à 60 % des patients) peuvent être à l’origine du diagnostic, que la MAV soit rompue ou non. Les céphalées surviennent dans près de 40 % des cas, et l’on peut avoir au moment du diagnostic des troubles de l’apprentissage ou un déficit neurologique. Des phénomènes de vol vasculaire pourraient être à l’origine de certains de ces symptômes, notamment des céphalées, mais cette physiologie est débattue [4, 7].
Comment la reconnaître à l’imagerie ?
Il faut privilégier l’IRM avec injection de produit de contraste au scanner pour confirmer le diagnostic de MAV (figure 3).
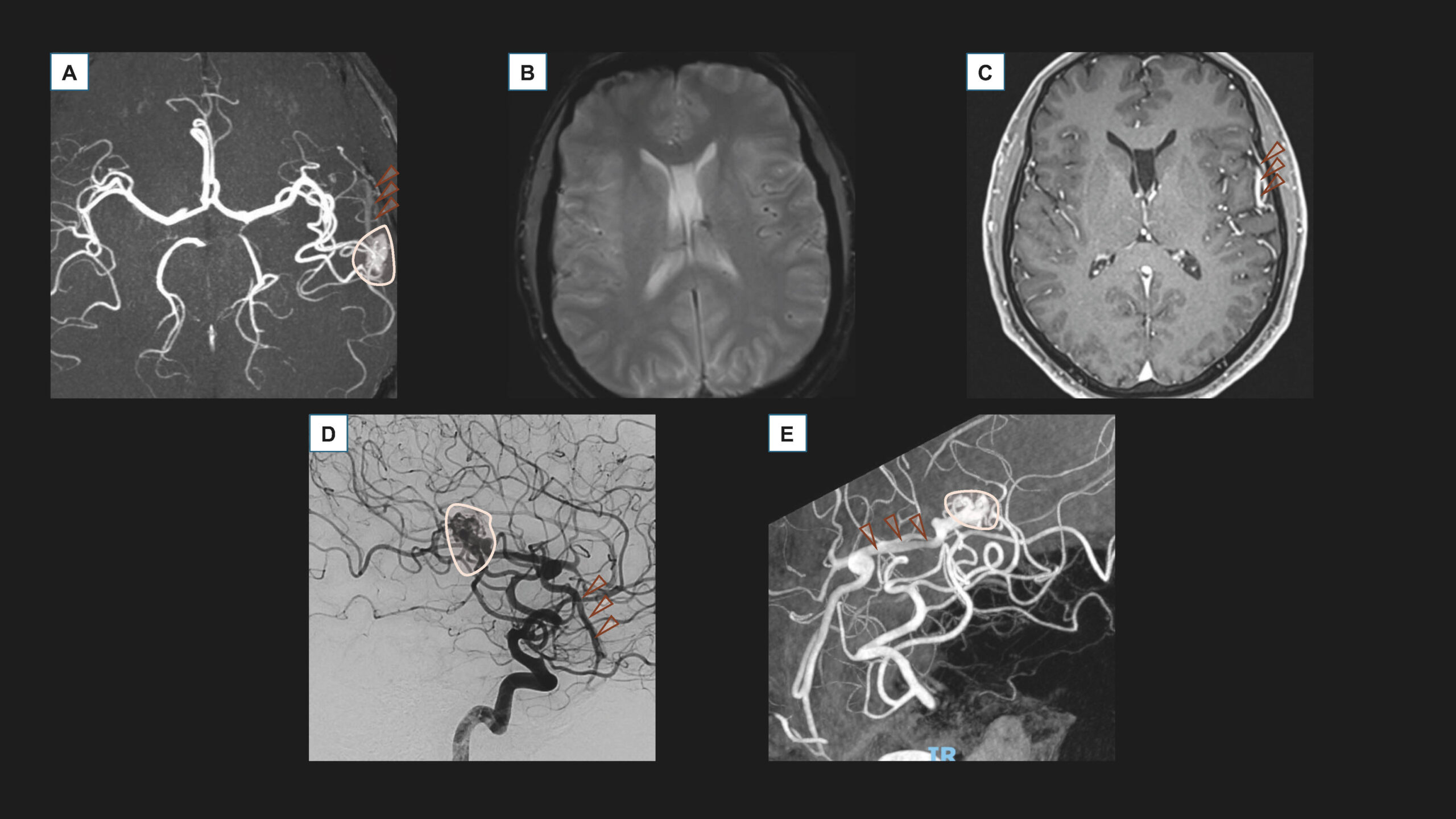
Figure 3. Imagerie d’une MAV intracrânienne frontale gauche non rompue. A. IRM sans injection, acquisition axiale TOF (Time Of Flight). B. IRM sans injection, acquisition axiale T2* (acquisition de susceptibilité magnétique). C. IRM avec injection, acquisition axiale EG (Écho de Gradient) T1. D. Artériographie sous anesthésie locale, injection dans l’artère carotide interne gauche, acquisition de profil. E. Artériographie sous anesthésie locale, injection dans l’artère carotide interne gauche, acquisition tridimensionnelle.Le bilan montre une MAV Spetzler-Martin 2 (Taille de 14 mm = 1, localisation éloquente = 1, drainage superficiel = 0), dont le nidus est surligné en rose pâle (A, D et E), alimentée par les branches centrales de l’artère cérébrale moyenne gauche. Elle se draine dans une veine corticale dilatée (têtes de flèches marron, A, C et D) se drainant dans la sylvienne superficielle gauche, sans signe de rupture ancienne ou récente visible sur la séquence de susceptibilité magnétique (B). Il n’y a pas de malformation anévrismale intranidale, ou d'anévrysme d'hyperdébit. Cette MAV avait été diagnostiquée dans un contexte de céphalées, sans rupture.© Héloïse Ifergan
Une malformation artérioveineuse est souvent de forme triangulaire, avec son apex dirigé vers le ventricule, et sa base parallèle à la surface corticale [4].
Les artères afférentes sont anormalement dilatées.
Son nidus, situé dans le parenchyme cérébral, peut être compact s’il n’y a pas d’interposition de tissu cérébral sain, ou diffus ou encore prolifératif, si du tissu sain y est présent [7]. Ce nidus peut mesurer de quelques millimètres à la taille de l’hémisphère entier [4].
Les veines de drainage apparaissent sous la forme de structures dilatées, d’aspect serpentin, et sont rehaussées précocement au temps artériel de l’injection [7].
Le parenchyme périlésionnel peut être siège de dépôt d’hémosidérine témoignant d’une hémorragie ancienne, d’œdème, et de calcifications résultant d’évènements ischémiques ou hémorragiques anciens [4].
Ce qui doit apparaître dans le compte rendu d’imagerie
Le compte rendu d’imagerie doit détailler les éléments suivants :
- topographie : éloquente (cortex sensitivomoteur, langagier ou visuel ; hypothalamus ou thalamus ; capsule interne ; tronc cérébral ; pédoncules cérébelleux, ou cervelet [8]) ou non éloquente ;
- description de la ou des artères afférentes ;
- 15 à 25 % des MAV étant associées à un anévrysme intracrânien [9, 10], il convient de préciser la présence d’un anévrysme intranidal, d’un anévrysme du polygone de Willis, ou d’un anévrysme d’hyperdébit. L’anévrysme d’hyperdébit et l’anévrysme intranidal sont particulièrement liés à un surrisque hémorragique ;
- mesure du plus grand axe du nidus ;
- description du drainage : présence d’une ou de plusieurs veines, d’un drainage superficiel ou profond, d’une sténose veineuse, d’un reflux veineux, d’un anévrysme veineux ;
- présence d’un stigmate hémorragique, ou d’une hémorragie récente ;
- éventuellement une estimation de la MAV selon la classification Spetzler Martin [8], bien qu’il s’agisse d’une classification angiographique ;
- présence éventuelle d’une hydrocéphalie associée ;
- On pourra retenir la description des facteurs de risque connus ou suspectés d’hémorragie que sont [6–10]:
- un stigmate de rupture,
- la localisation infratentorielle,
- la présence d’un drainage veineux profond,
- la localisation profonde. Les présences d’un anévrysme associé, d’un drainage veineux unique, d’une sténose ou d’une dilatation veineuse associée sont plus discutées comme étant facteurs de risque hémorragique.
Quel est l’examen de référence et qu’y voit-on ?
La suspicion d’une MAV, rompue ou non rompue, doit faire conduire à réaliser une artériographie (figure 3 et 4), au bloc opératoire, après consultation en neuroradiologie interventionnelle. Les risques d’une telle intervention sont exceptionnels, et dominés par les complications aux points de ponction et les AVC et AIT par emboles ischémiques [11].
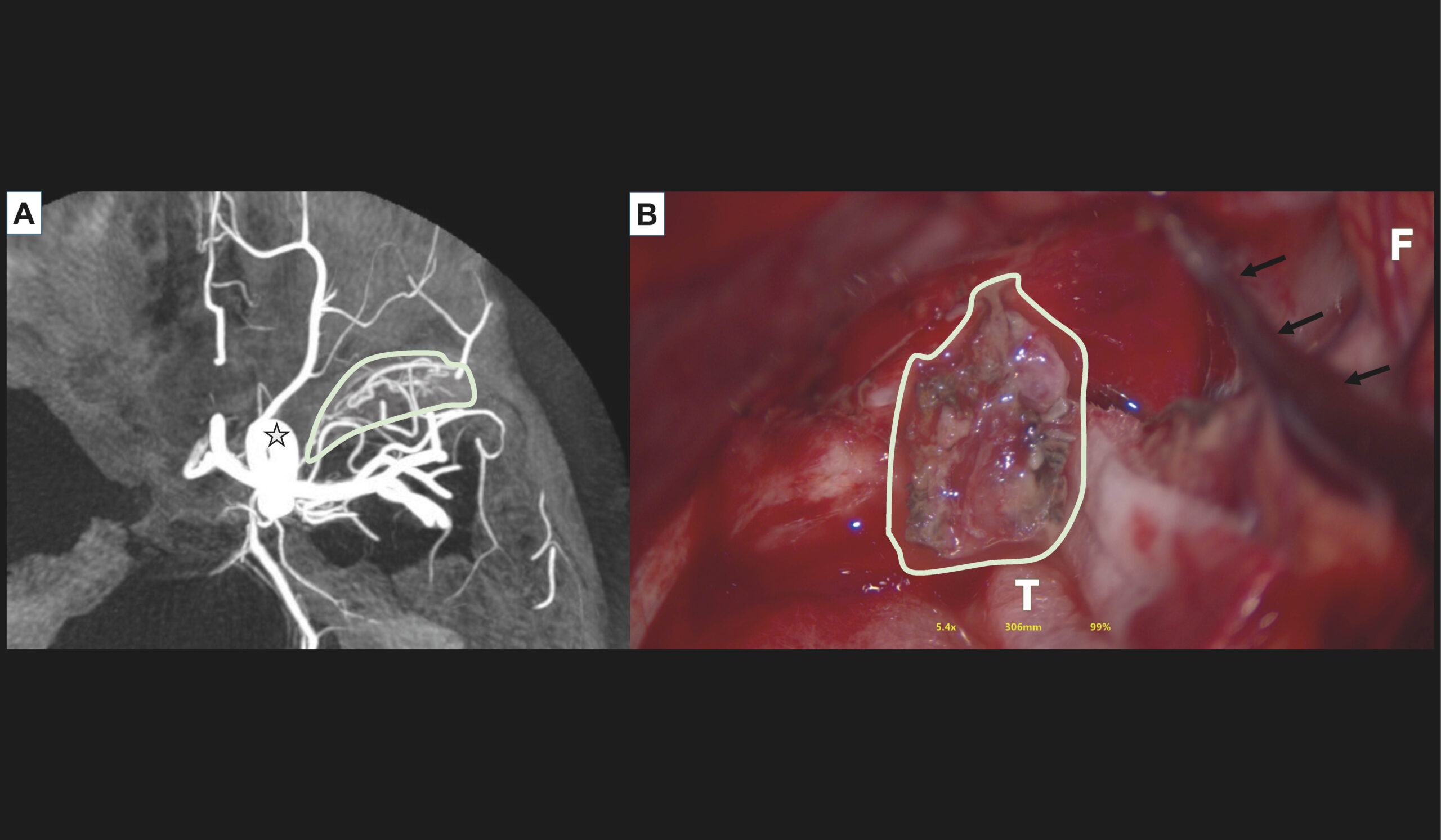
Figure 4. Artériographie (angiographie par soustraction numérique ou DSA) et vue peropératoire d’une MAV temporopolaire gauche. A. Artériographie sous anesthésie générale, avec acquisition tridimensionnelle dans l’axe carotidien interne gauche montrant une MAV temporale gauche présentant des afférences issues de l'artère carotide interne gauche (tronc inférolatéral), un nidus infracentimétrique et un drainage veineux dans le sinus caverneux via le sinus sphénopariétal. Étoile noire et blanche : carotide interne gauche. B. Vue peropératoire de cette MAV. F : lobe frontal. T : lobe temporal. Flèches blanches : veine sylvienne superficielle. La MAV est surlignée et cerclée en blanc dans A et B. Cette MAV n’était pas décelable sur l’imagerie en coupes, sous l’effet d’un important saignement intracrânien évacué lors de la procédure chirurgicale.© Héloïse Ifergan
Cet examen analyse plus précisément la malformation, et permet notamment de comprendre si les artères sont terminales, c’est-à-dire qu’elles se terminent dans la MAV, ou pseudo-terminales, les artères nourricières vascularisent alors la MAV, puis du tissu parenchymateux sain, ou enfin « en passage » si les artères arrivent à angle droit d’artères normales. Elle est nécessaire à la prise de décision thérapeutique.
Si la MAV est rompue, cette procédure peut se faire d’emblée sous anesthésie générale afin de la traiter, ou d’en traiter des zones de fragilité, dans le même temps opératoire. Les risques sont alors ceux de l’embolisation et de l’anesthésie générale.
Quelle prise en charge sera proposée à ces patients ?
La prise en charge est pluridisciplinaire : la neurochirurgie, la neuroradiologie interventionnelle, la radiochirurgie stéréotaxique, la neurologie, et idéalement, un psychologue et une association de patients comme pour toute pathologie chronique, interviennent dans la prise en charge d’une malformation artérioveineuse.
Les trois premières spécialités traitent spécifiquement la MAV, et un traitement combiné de deux ou des trois techniques peut être réalisé.
La balance bénéfice / risque n’est pas forcément en faveur du traitement de la MAV, a fortiori pour les MAV non rompues au vu des complications possibles des différents traitements [12]. Néanmoins, après discussion pluridisciplinaire, il peut être décidé de traiter la MAV pour son potentiel hémorragique.
L’épilepsie [13] et les céphalées ne sont pas habituellement un critère de traitement, bien que ce point soit à l’heure actuelle encore débattu.
La chirurgie (figure 4) et la neuroradiologie interventionnelle ont l’avantage d’avoir un effet immédiat, au contraire de la radiochirurgie stéréotaxique qui a un effet thérapeutique jusqu’à deux ans après la procédure, mais ces deux premières techniques sont néanmoins associées à un surrisque de morbimortalité non négligeable.
Comment ces patients doivent-ils être surveillés ?
La surveillance de ces patients se fait à vie, le plus souvent annuellement à l’aide d’une IRM et d’une consultation. Une artériographie peut être préconisée, notamment dans l’année suivant la prise en charge chirurgicale ou endovasculaire, et dans les trois ans après prise en charge en radiochirurgie.
Fistule durale
Modes de présentation clinique
La découverte d’une fistule se fait le plus fréquemment à l’âge adulte. La présentation clinique dépend de la localisation de la fistule. On peut retenir néanmoins comme principaux symptômes au moment du diagnostic :
- l’acouphène pulsatile, présent chez 60 % des patients porteurs d’une fistule durale [2]; la fistule durale est par ailleurs la cause la plus fréquente des acouphènes typiquement pulsatiles ;
- l’hémorragie intracrânienne est associée à une mortalité de 20 % [2]. Ce risque est majoré lorsqu’il existe un drainage veineux cortical, et que le point dit de « shunt », ou de communication, est tentoriel [14].
D’autres signes peuvent être présents comme des troubles cognitifs d’apparition rapide, des signes ophtalmologiques avec un œil rouge avec ophtalmoplégie en cas de fistule carotidocaverneuse, des céphalées, des crises convulsives, ou des signes de myélopathie (fistule de type V, voir après) [3]).
Comment la reconnaître à l’imagerie ?
Une IRM avec un TOF non injecté doit au minimum être réalisée (figure 5).
La fistule se situe le plus souvent dans les sinus transverses et sigmoïdes (35 %), puis atteint le sinus caverneux (35 %), l’étage antérieur de la base du crâne (5 %) et la tente du cervelet (5 %) [2].
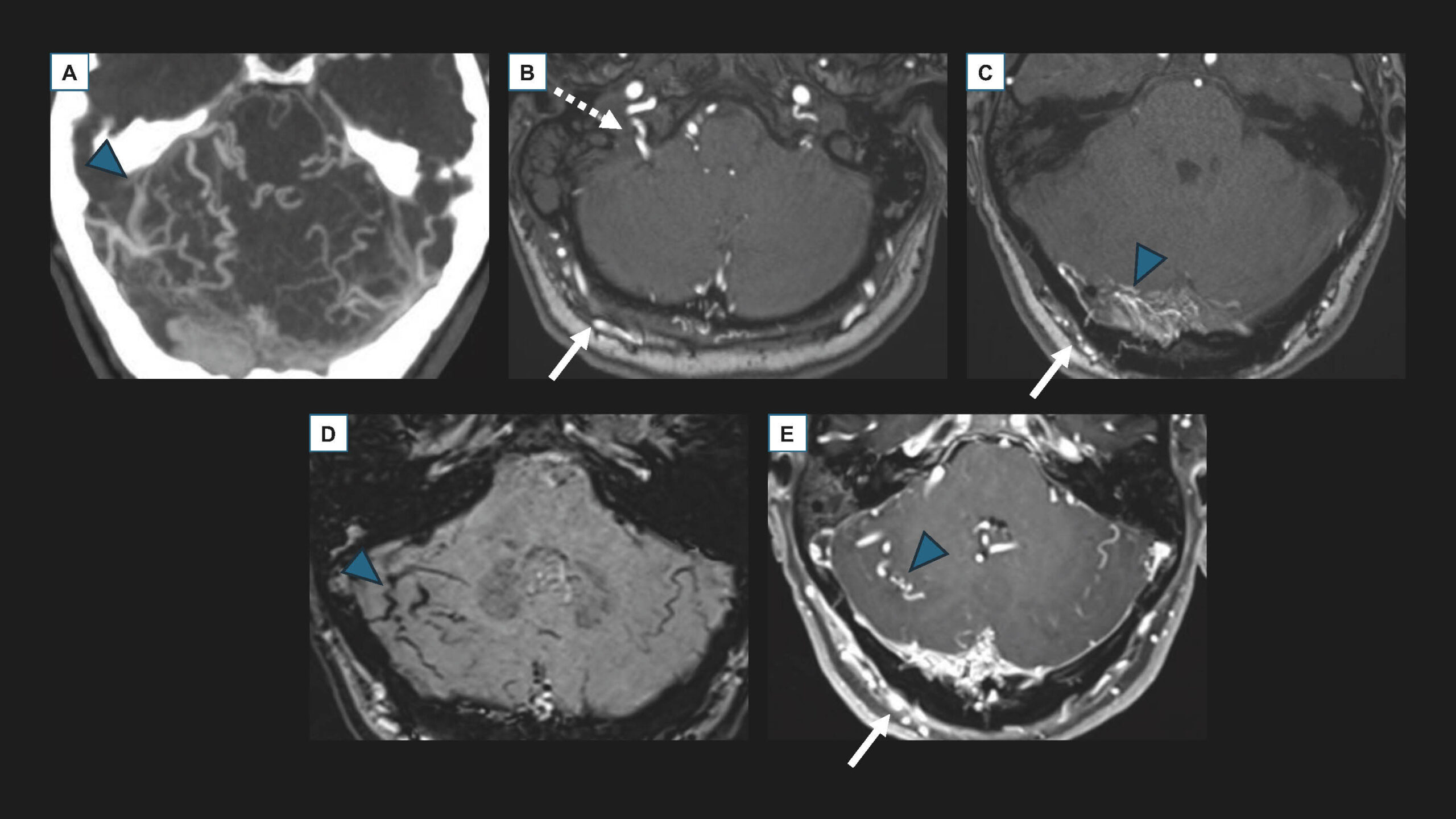
Figure 5. Imagerie en coupes d’une fistule durale du sinus latéral et de la tente du cervelet (grade II a+b). A. Scanner avec injection au temps artériel, acquisition axiale en projection MIP (Maximal Intensity Projection). B et C. IRM sans injection, acquisition axiale TOF (Time Of Flight). D. IRM sans injection, acquisition axiale SWI (Susceptibility Weighted Imaging). E. IRM avec injection, acquisition axiale EG (Écho de Gradient) T1. Ces imageries mettent en évidence en fosse postérieure des structures dilatées, serpigineuses, correspondant à des veines anormales (têtes de flèches bleues), se rehaussant précocement au temps artériel au scanner (A), sièges d’un flux rapide anormalement visible sur la séquence TOF (C), engorgées et sièges de « flow-voids » (D), se rehaussant de façon anormale après injection de produit de contraste (E).Les artères afférentes (flèche blanche : artère occipitale, flèche blanche en pointillé : artère pharyngienne ascendante) sont anormalement visibles en TOF (B et C) et se rehaussent anormalement après injection de produit de contraste (E).© Héloïse Ifergan
L’imagerie en coupes, scanner ou IRM, permet de mettre en évidence des signes d’hypertension veineuse ou d’engorgement veineux comme une hémorragie, un œdème (œdème vasogénique à l’IRM), des structures tubulaires correspondant à des veines piales engorgées dilatées se rehaussant de façon anormale, une ectasie veineuse [3]. Ces veines corticales engorgées se voient sous la forme de « flow voids » au sein des sillons corticaux à l’IRM.
Des calcifications curvilignes sous-corticales peuvent être éventuellement visibles au scanner, probablement liées à de la congestion veineuse chronique [7].
Les artères afférentes peuvent être mieux visibles car dilatées et sièges d’une modification de leur résistance avec un hyperdébit, visible sous la forme notamment d’un hypersignal TOF sur une IRM non injectée.
Ce qui doit apparaître dans le compte rendu d’imagerie
Le compte rendu d’imagerie doit détailler les éléments suivants :
- topographie suspectée : sinus transverse, sinus sigmoïde, sinus caverneux, étage antérieur de la base du crâne, tente du cervelet, etc. ;
- artères et veines suspectes d’être afférentes et efférentes ;
- présence d’une stagnation veineuse piale, visible sous la forme de structures serpigineuses anormales intracrâniennes (type IIb ou III, voir après) ;
- présence d’un anévrysme veineux (type IV, voir après) ;
- des signes associés : un œdème de la substance blanche par congestion veineuse, une hydrocéphalie, un stigmate de saignement ou un saignement récent.
Quel est l’examen de référence et qu’y voit-on ?
Il est important de noter qu’une IRM et un scanner normaux n’éliminent pas la présence d’une fistule durale. En cas de présomption forte de fistule durale avec imagerie en coupes normale, une artériographie dans un centre de neuroradiologie interventionnelle doit être préconisée [15] (figure 6).
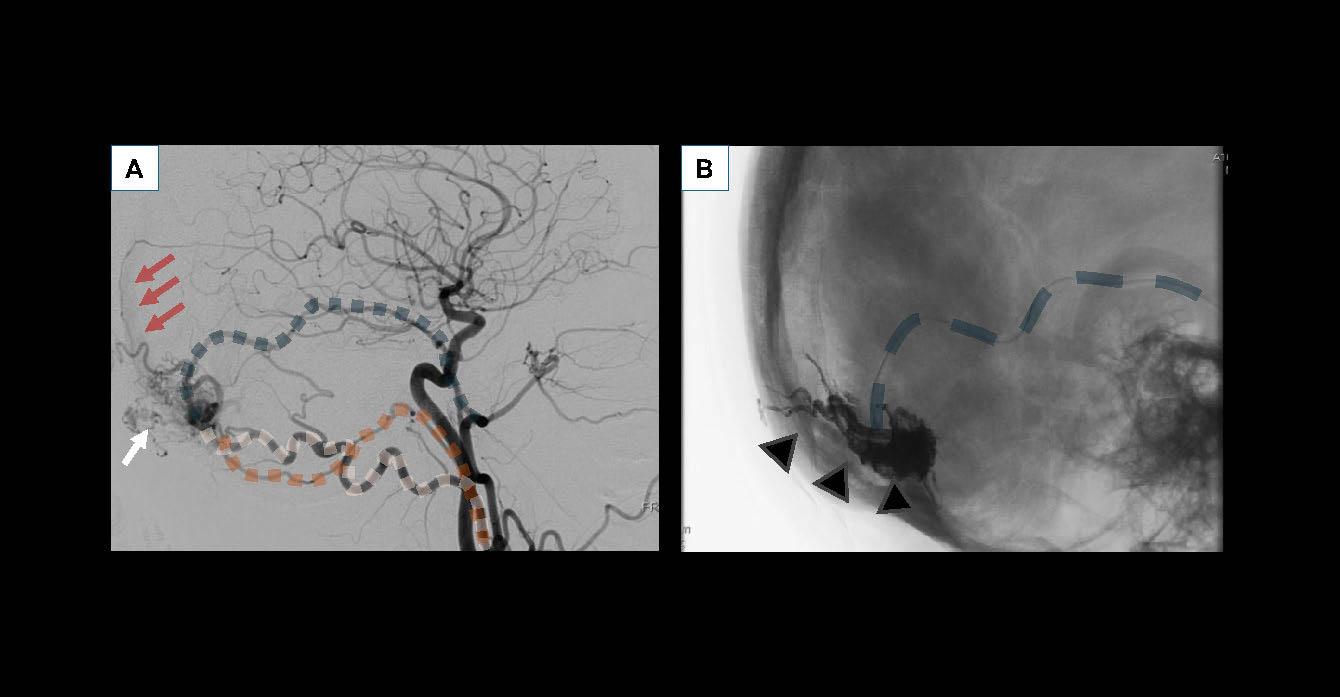
Figure 6. Artériographie (angiographie par soustraction numérique ou DSA) sous anesthésie générale pour embolisation de cette même fistule durale. A. Acquisition axiale soustraite en début d’intervention, avec injection dans l’artère carotide commune droite. On retrouve les artères afférentes dilatées (artère méningée moyenne en bleue, occipitale en rose, pharyngienne ascendante en orange), alimentant la fistule, siège d’un recrutement de néovaisseaux (flèche blanche), avec retour veineux anormalement visible au sein du sinus longitudinal supérieur (flèches rouges). B. Acquisition axiale non soustraite au cours de l’intervention.Injection d’Onyx® liquid embolic system (LES) (têtes de flèches noires et grises) ayant pénétré la fistule, à l’aide d’un microcathéter ayant navigué en distalité dans l’artère méningée moyenne droite (traits bleus). La procédure a permis une guérison complète de la fistule.© Héloïse Ifergan
Elle permet de classer la fistule de I à IV selon la classification de Cognard-Lariboisière [16]. Les types I, II et IIa sont dit bénins car les veines corticales intracrâniennes ne sont pas contaminées par la fistule (type I : drainage dans un sinus, avec un flux antérograde physiologique ; type II : drainage dans un sinus et IIa : avec reflux dans un sinus). Les types IIb, IIa+b, III, IV sont potentiellement graves car associés à un risque hémorragique intracrânien (IIb : drainage dans un sinus avec reflux dans une veine corticale ; IIa+b : drainage dans un sinus avec reflux dans un sinus et une veine corticale ; type III : drainage dans une veine corticale sans ectasie veineuse ; type IV : drainage dans une veine corticale, siège d’une ectasie). Le dernier type, type V, correspond à un drainage dans des veines périmédullaires spinales.
En ce qui concerne la fistule carotidocaverneuse, celle-ci peut être classée selon la classification de Barrow [17] selon son caractère direct – le point de shunt se situe alors entre l’artère carotide interne et le sinus caverneux – ou indirecte si les afférences artérielles se font grâce à des artères à destinée méningée.
Quelle prise en charge sera proposée à ces patients ?
La prise en charge spécifique de cette pathologie dépend de son grade : s’il n’existe pas de reflux dans une veine corticale (grades I à IIa inclus), un traitement peut être proposé en cas d’acouphène invalidant, ou encore s’il s’agit d’une fistule carotidocaverneuse avec un risque fonctionnel de cécité.
S’il existe un retour veineux intracrânien (grades IIb à V), il y a un risque hémorragique, avec un taux de mortalité annuel aux alentours de 10 % [3], et une prise en charge thérapeutique est systématiquement proposée.
Dans le cas où une prise en charge thérapeutique est préconisée, celle-ci se fait par traitement endovasculaire en première intention (image VI), ou par chirurgie ; dans certains cas, une radiochirurgie, ou une combinaison de ces trois traitements peut être proposée.
Enfin, dans certains cas de fistule sans risque hémorragique, il peut être proposé au patient une manœuvre d’autocompression artérielle (carotide interne ou occipitale) par la main controlatérale, trois fois par jour, avec un taux de guérison rapportée entre 20 à 30 % des cas [3].
Comment ces patients doivent-ils être surveillés ?
La plupart du temps, une surveillance au long cours sera réalisée, par imagerie non invasive de type IRM, éventuellement complétée par une artériographie.







Discussion
Aucun commentaire
Commenter cet article