Introduction
La réalisation d’examens d’imagerie pour la quantification non invasive de la stéatose hépatique devient de plus en plus récurrente dans la pratique clinique. L’incidence de la maladie du foie gras non alcoolique (non alcoholic fatty liver disease – NAFLD) a augmenté au cours des dernières décennies et sa prévalence mondiale actuelle est d’environ 30 % [1]. La NAFLD est associée à d’autres conditions pathologiques comme l’obésité, l’hypertension artérielle, le diabète de type 2 et le syndrome métabolique [2, 3]. De plus, la NAFLD peut se compliquer d’une atteinte inflammatoire. Cette forme inflammatoire, la stéatohépatite non alcoolique (non alcoholic steatohepatitis – NASH), peut évoluer vers la cirrhose et ses complications (notamment l’hypertension portale et le carcinome hépatocellulaire) [1, 4, 5]. Parallèlement à la quantification de la stéatose hépatique, l’imagerie joue un rôle important dans l’évaluation non invasive de l’inflammation et de la fibrose hépatique chez les patients avec NASH, notamment grâce aux techniques d’élastographie, mais ce sujet ne sera pas traité dans cet article.
En dehors des patients atteints d’une NAFLD/NASH, la détection et la quantification de la stéatose sont importantes dans d’autres contextes cliniques :
- chez les patients atteints d’une hépatite virale car la présence d’une stéatose augmente la rapidité de progression de la fibrose [6];
- chez les patients qui ont reçu un traitement de chimiothérapie, pour lesquels la présence d’une stéatose ou d’une stéatohépatite est un facteur de risque de complications majeures en cas de chirurgie hépatique [7];
- dans un contexte d’évaluation du foie avant transplantation d’organe, car la présence d’une stéatose modérée ou sévère est considérée comme une contre-indication à l’explant de l’organe [8].
La stéatose hépatique est définie en anatomopathologie comme une surcharge en graisse (sous forme de vacuoles) d’au moins 5 % des hépatocytes du parenchyme hépatique. Elle est typiquement classifiée selon le score de Brunt en 4 grades (figure 1) [9] : S0 (absent), < 5 % ; S1 (faible), 5-33 % ; S 2 (modérée), 33-66 % ; S3 (sévère), > 66 %.
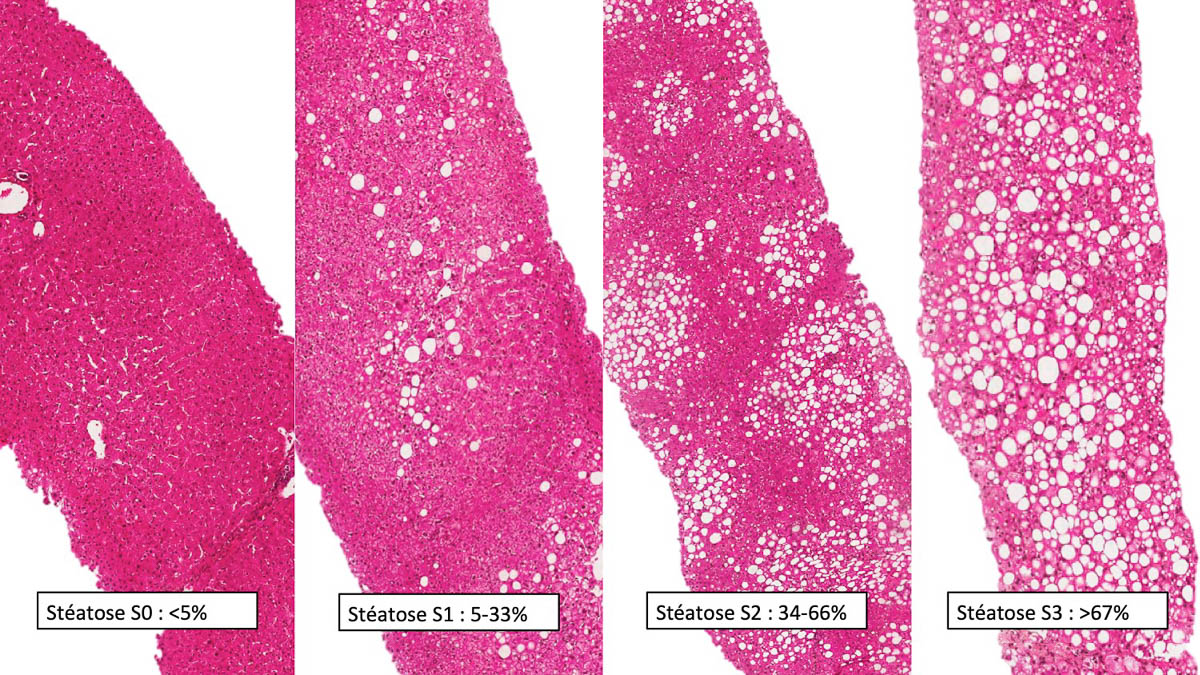
Figure 1. Classification de la stéatose selon Brunt. La stéatose est classée en 4 grades, de S0 à S3 en fonction du taux d’hépatocytes qui contiennent des vacuoles de graisse. © Aurélie Beaufrere, service d'anatomopathologie, hôpital Beaujon - Clichy.
Le rôle des principales techniques d’imagerie (échographie, scanner et IRM) pour la quantification de la stéatose, va être détaillé dans cet article.
Échographie pour l’évaluation de la stéatose hépatique
L’accumulation de la graisse dans le parenchyme hépatique se traduit à l’échographie par une majoration de l’échogénicité (le foie est « brillant »), associée à une majoration de l’atténuation des ultrasons et donc à une réduction de la visibilité des structures plus profondes.
Approche semi-quantitative
L’évaluation semi-quantitative de la stéatose hépatique est la plus fréquemment utilisée dans la pratique clinique. Cette approche est basée sur la comparaison de l’échogénicité du parenchyme hépatique avec celle du parenchyme rénal adjacent. En absence de stéatose, le parenchyme hépatique est isoéchogène par rapport à la corticale rénale. Plus la stéatose est sévère, plus le foie devient hyperéchogène par rapport à la corticale rénale. En pratique, en réalisant une coupe échographique foie-rein, la stéatose est classée visuellement en 4 grades : absente, faible, modérée et sévère (figure 2).
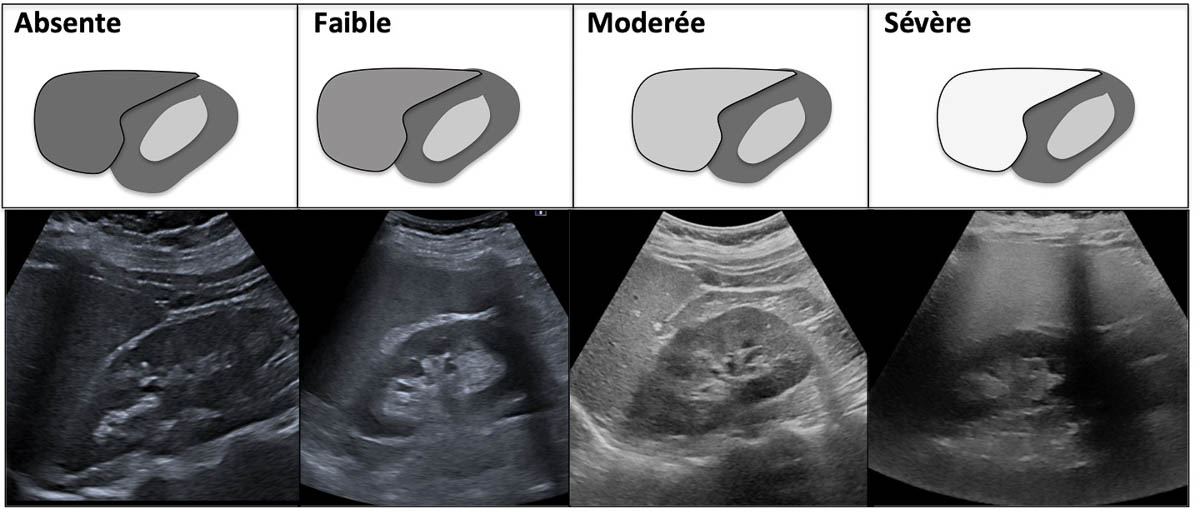
Figure 2. Approche semi-quantitative pour l’évaluation de la stéatose hépatique. La stéatose est classée visuellement en comparant l’échogénicité du parenchyme hépatique à celle du rein droit. © Marco Dioguardi Burgio
Cette approche, simple, est assez efficace pour la détection d’une stéatose de grade modéré ou sévère. Toutefois, elle présente plusieurs problèmes qui limitent son rôle dans la pratique clinique :
- cette mesure n’est pas quantitative et ne peut donc pas être utilisée pour la surveillance de l’évolution de la stéatose dans le temps ;
- l’accord interobservateur est mauvais, notamment pour la stéatose de faible abondance [10];
- la sensibilité est limitée pour le diagnostic de stéatose de faible abondance (S0 vs S1) [11];
- elle ne peut être appliquée s’il existe une pathologie rénale associée.
D’autres signes peuvent être recherchés en association à l’aspect hyperéchogène du foie pour diagnostiquer une stéatose hépatique, notamment l’augmentation du gradient d’échogénicité foie/vaisseaux, la réduction de la visibilité des structures plus profondes et la moins bonne visualisation des structures anatomiques intrahépatiques (notamment les vaisseaux portes) [12] liée à l’augmentation des phénomènes d’atténuation ultrasonore.
Approche quantitative
Une méthode quantitative simple, qui ne nécessite pas de logiciel dédié, est la mesure de l’index hépatorénal (hepato-renal index, HRI). Elle consiste à positionner 2 régions d’intérêt (region of interest – ROI), sur une image en mode B foie-rein. Une première ROI est positionnée dans la corticale rénale. L’autre est positionnée au sein du parenchyme hépatique, à la même profondeur pour éviter des modifications de la mesure liées à l’atténuation des ultrasons (figure 3).
Une première étude réalisée par Webb et coll. a montré une bonne corrélation entre l’HRI et la stéatose évaluée en histologie (r = 0.82) et de très bonnes performances diagnostiques. La valeur seuil de HRI de 1,49 avait notamment une sensibilité de 100 % et une spécificité de 91 % pour le diagnostic de stéatose S1 (> 5 %). Cependant, la variabilité des valeurs seuils et des performances diagnostiques reportées dans d’autres séries [13, 14] sont les facteurs qui peuvent limiter son application.
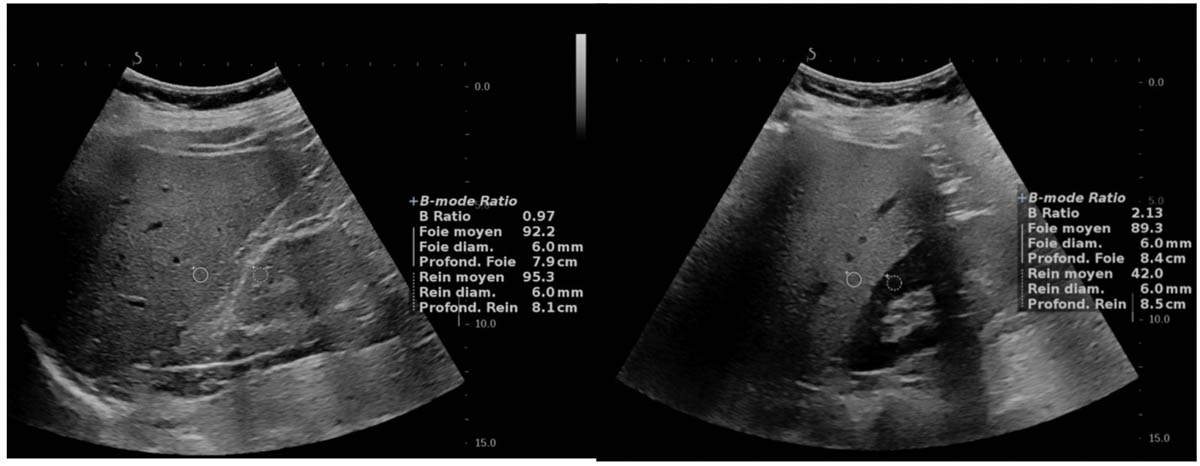
Figure 3. Mesure de l’index hépatorénal. Les régions d’intérêt sont positionnées sur le parenchyme hépatique et rénal, à la même profondeur. Dans le premier cas (image à gauche), l’index est mesuré à 0,97, en rapport avec l’absence de stéatose. Dans le deuxième cas (image à droite), l’index mesuré à 2,13 confirme la présence d’une stéatose modérée – sévère. © Marco Dioguardi Burgio
Au cours des dernières années, un certain nombre de méthodes quantitatives échographiques ont été développées. Elles reposent sur différents principes théoriques comme la mesure du coefficient d’atténuation (figure 4) [15, 16], de la vitesse du son [17] ou de la rétrodiffusion des ultrasons [18]. Ces méthodes ont l’avantage d’être basées uniquement sur l’évaluation du parenchyme hépatique et de fournir des mesures objectives et reproductibles dans le temps. Ces applications sont encore pour la plupart des outils de recherche et devront être validées dans les années à venir, mais il est très probable qu’elles joueront un rôle fondamental dans l’approche échographique multiparamétrique du patient stéatosique.
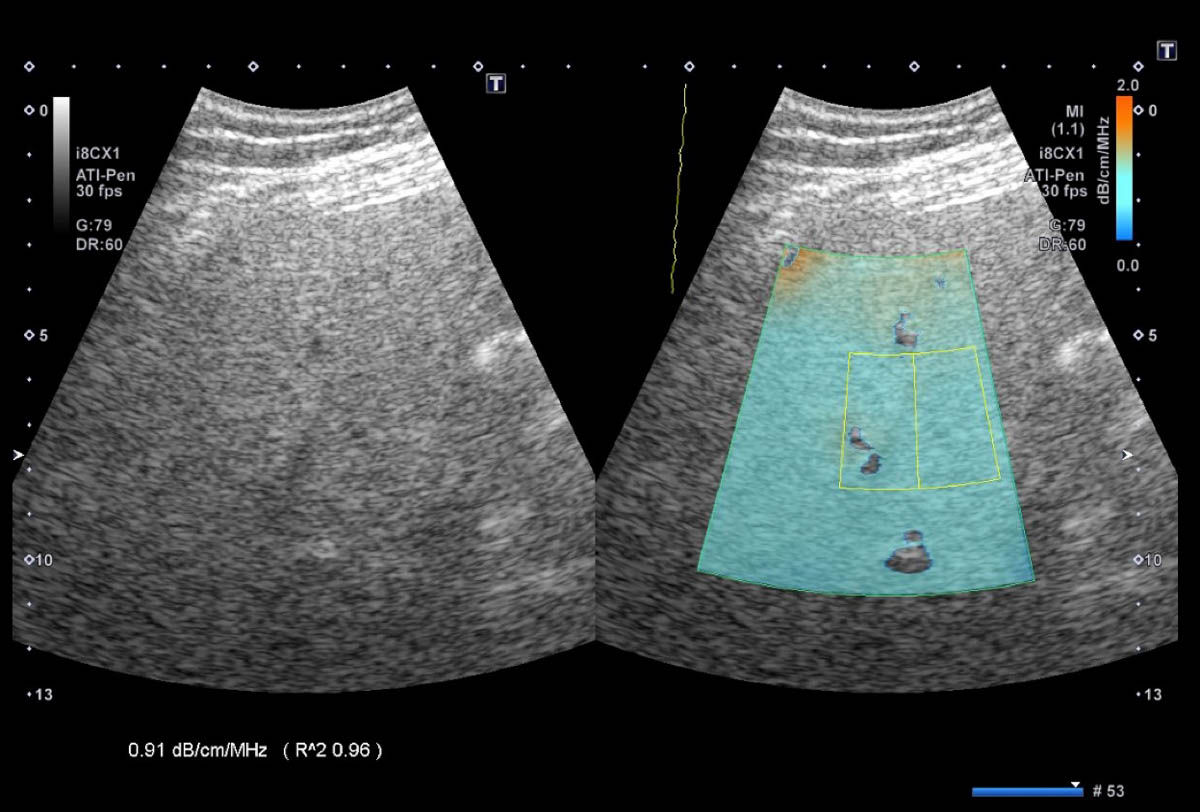
Figure 4. Mesure du coefficient d’atténuation. À gauche l’image en mode B standard. À droite, la quantification de l’index d’atténuation (exprimé en dB/cm/MHz) est évaluée dans la région d’intérêt sélectionnée par le radiologue. L’index mesuré à 0,91 dB/cm/MHz, correspond à une stéatose sévère. © Marco Dioguardi Burgio
Évaluation de la stéatose hépatique par scanner
L’évaluation de la stéatose hépatique par scanner se base sur la mesure de la densité. La graisse est moins dense que le parenchyme hépatique. Pour cette raison, la présence d’une stéatose se traduira par une réduction de la densité hépatique.
Évaluation semi-quantitative
Une méthode simple consiste à réaliser une comparaison semi-quantitative, visuelle, de la densité du parenchyme hépatique et de celle des vaisseaux intrahépatiques. À cause de la réduction de densité du parenchyme hépatique, les vaisseaux intrahépatiques seront visualisés comme isodenses ou même hyperdenses par rapport au parenchyme hépatique, en fonction de la gravité de la surcharge graisseuse (figure 5).
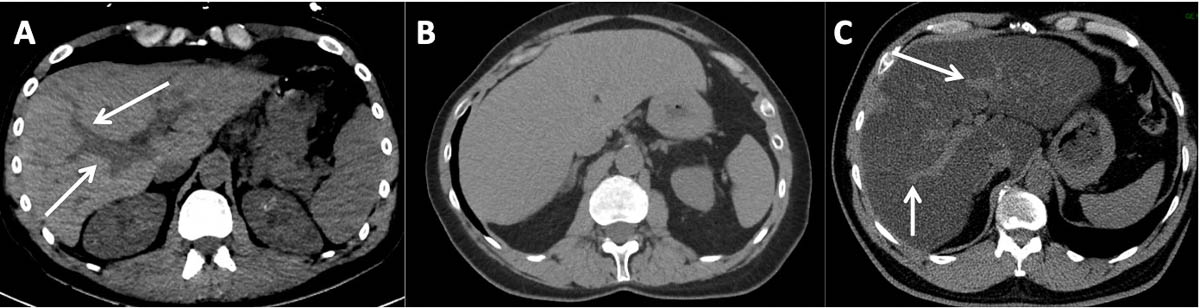
Figure 5. Exemples de différents grades de stéatose au scanner non injecté. Dans un foie non stéatosique (A), le parenchyme hépatique est spontanément hyperdense par rapport aux vaisseaux intrahépatiques (flèches) qui sont bien visibles jusqu’en périphérie. Dans un foie modérément stéatosique (B), la densité du foie est réduite et les vaisseaux intrahépatiques ne seront plus individualisables (isodenses au parenchyme). Dans un foie très stéatosique (C), la densité du parenchyme hépatique est fortement réduite et spontanément hypodense par rapport aux vaisseaux intrahépatiques (flèches). © Marco Dioguardi Burgio
Évaluation quantitative
Le scanner permet aussi une évaluation quantitative utilisant la mesure de la densité dans des régions d’intérêt du parenchyme : le foie a une valeur d’atténuation supérieure à celle de la rate, de 8 – 10 unités Hounsfield (UH) [19]. Sur un scanner non injecté, une densité spontanée du foie < 40 UH ou une densité du foie inférieure à celle de la rate d’au moins 10 UH sont des bons marqueurs de stéatose hépatique modérée (> 30%). Récemment, certains groupes ont montré l’intérêt du scanner à double énergie dans la quantification de la stéatose hépatique [20, 21]. Ces résultats intéressants doivent être validés sur des cohortes plus larges.
Bien que le scanner non injecté donne de meilleurs résultats que le scanner injecté dans la quantification de la stéatose [22], le diagnostic d’une faible surcharge stéatosique (< 30 %) et la quantification précise de la surcharge en graisse intrahépatique restent difficiles à réaliser.
Le scanner n’est pas une modalité de première intention
L’exposition du patient aux rayons X et les performances diagnostiques limitées pour la détection de stéatose de faible grade sont les limites principales de l’utilisation du scanner pour la quantification de la stéatose. Le scanner n’est pas indiqué en première intention pour la recherche et la quantification de la stéatose hépatique. Néanmoins, les techniques décrites permettent d’évaluer la surcharge en graisse intrahépatique une fois que l’imagerie est réalisée pour une autre indication.
Quantification de la stéatose hépatique par IRM
L’IRM est considérée comme l’examen de référence pour le diagnostic et la quantification de la stéatose hépatique. Les techniques d’IRM pour l’évaluation de la stéatose sont basées sur la différence de la fréquence de résonance (et donc du signal reçu) entre les protons mobiles de l’eau et de la graisse (principalement les triglycérides).
Spectroscopie
La spectroscopie une technique extrêmement précise pour la quantification de la stéatose [23]. Cette méthode permet de séparer les pics du signal de l’eau et de la graisse et de calculer la fraction (%) de graisse par rapport à celle de l’eau. Cependant, plusieurs facteurs limitent sa diffusion dans la pratique clinique, notamment le coût de l’examen, le long temps d’acquisition des séquences, la restriction de l’exploration à une petite portion du parenchyme hépatique (voxel d’exploration) et la sensibilité aux artefacts de mouvement [24, 25].
Dixon et mDixon
En utilisant des séquences multi-écho, ces méthodes permettent de séparer le signal de l’eau et de la graisse et de réaliser 4 types d’images : images en phase (signal de l’eau + signal de la graisse), images en opposition de phase (signal de l’eau – signal de la graisse), images du signal de l’eau et images du signal de la graisse. Les méthodes plus simples utilisent seulement 2 ou 3 échos et permettent une évaluation qualitative (la stéatose est visualisée comme une chute de signal dans les séquences en opposition de phase), tandis que pour une quantification, il est nécessaire de réaliser au moins un train de 6 échos [24].
PDFF (proton density fat fraction)
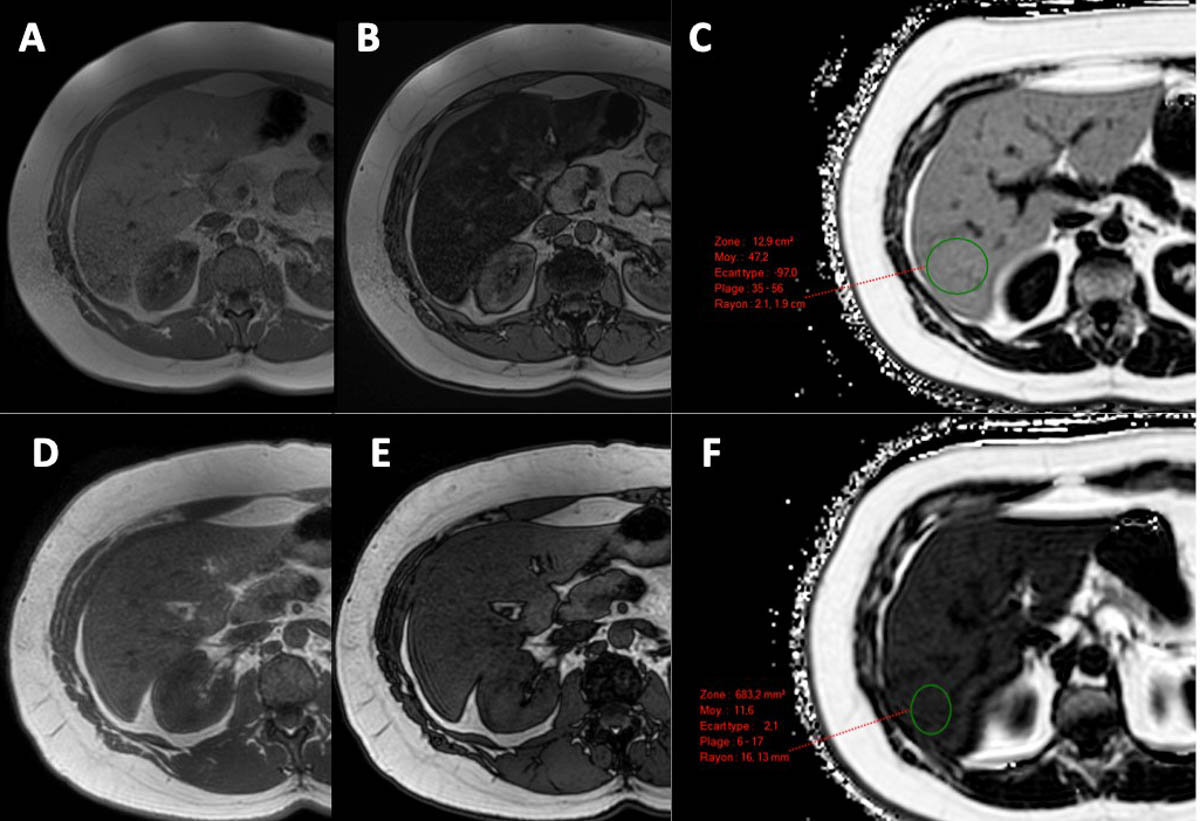
C’est la mesure du rapport entre la densité des protons mobiles des triglycérides et la totalité des protons mobiles des triglycérides et de l’eau [24]. Des séquences (multi-écho) dédiées à la quantification de la PDFF (figure 6) sont aujourd’hui disponibles sur tous les principaux systèmes IRM. Les séquences sont réalisées en une seule apnée d’environ 15-20 secondes. Les cartes de PDFF sont générées automatiquement et permettent au radiologue de choisir la zone du parenchyme hépatique où effectuer la mesure, tout simplement en positionnant une région d’intérêt (figure 6). La valeur de PDFF, exprimée en %, peut être facilement utilisée pour la surveillance de l’évolution de la stéatose (figure 6).
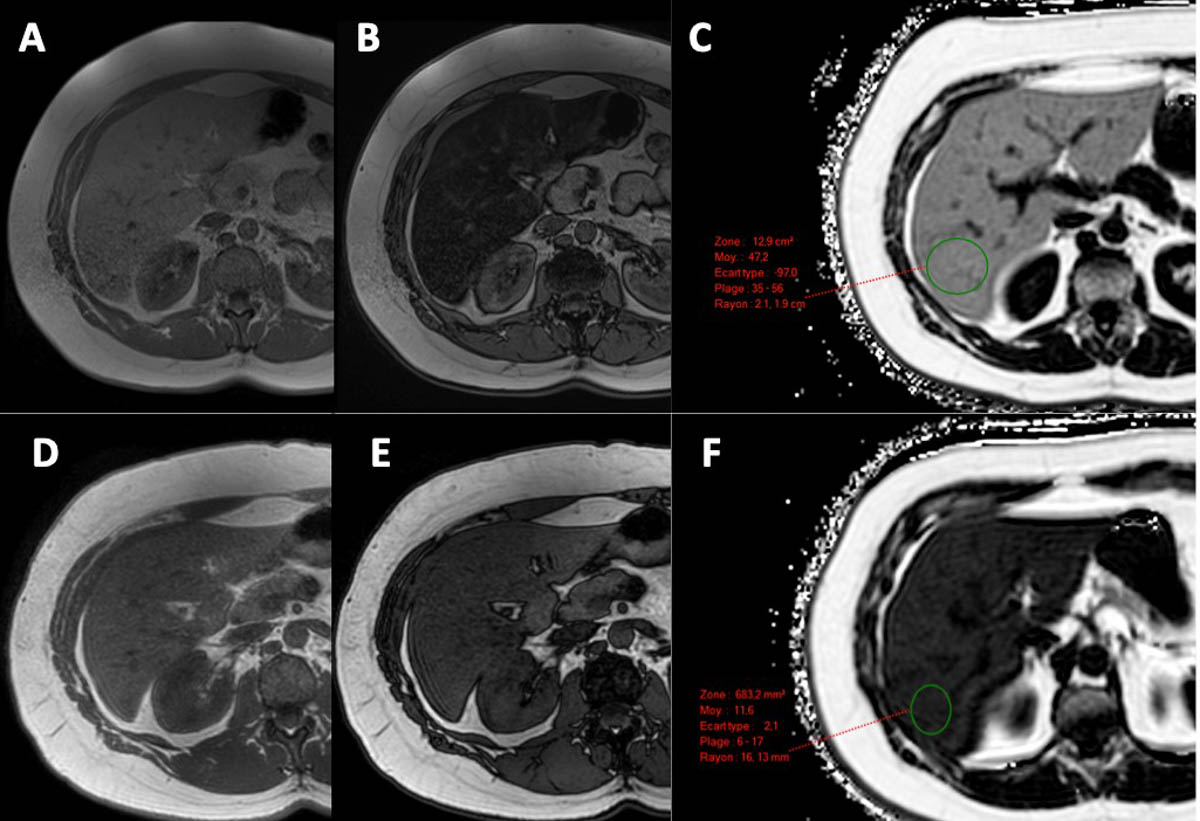
Figure 6. Quantification de la graisse par IRM à 8 mois d’intervalle avec des séquences mDixon et des séquences de quantification de la PDFF. Au premier contrôle IRM (A-B-C), on note la chute très marquée de signal dans la séquence en opposition de phase (B) par rapport à la séquence en phase (A). La PDFF est évaluée à 47,2 % (C), confirmant la présence d’une stéatose sévère. Le contrôle IRM réalisé à 8 mois d’intervalle (D-E-F) montre la persistance d’une chute de signal sur la séquence en opposition de phase (E) par rapport à la séquence en phase (D), mais moins marquée qu’au premier examen. La PDFF est quantifiée à 11,6 % (F), ce qui témoigne d’une nette réduction de la surcharge en graisse intrahépatique. © Marco Dioguardi Burgio
Les valeurs de PDFF (en %) sont très fortement corrélées à la stéatose (taux d’hépatocytes qui contiennent de la graisse) évaluée en histologie. Néanmoins, cette correspondance n’est pas linéaire. Les valeurs seuils de PDFF pour la classification des grades de stéatose par rapport aux scores histologiques ne sont pas encore strictement définies, mais une méta-analyse récente a montré des valeurs optimales de PDFF entre 3,42 % et 6,90 % pour la détection de la stéatose ≥ S1, entre 10 % et 17,5 % pour ≥ S2 et entre 16,37 % et 23,50 % pour S3 [26]. Les performances diagnostiques de la PDFF pour le diagnostic de stéatose sont très bonnes, avec une aire sous la courbe de 0,98 pour une stéatose ≥ S1 [26].
Conclusions
Ces dernières années, différentes modalités d’imagerie pour la quantification non invasive de la stéatose hépatique ont été développées. Parmi ces méthodes, l’IRM avec la mesure de la PDFF est considérée aujourd’hui comme l’examen de référence. Cependant, compte tenu du coût de l’IRM et de son accessibilité relativement limitée sur le territoire, l’échographie reste l’examen le plus utilisé dans la pratique clinique pour le dépistage de la stéatose hépatique. Il est important pour le radiologue de se familiariser avec toutes ces nouvelles méthodes de quantification qui seront de plus en plus utilisées dans les années à venir en pratique clinique.







Discussion
Aucun commentaire
Commenter cet article