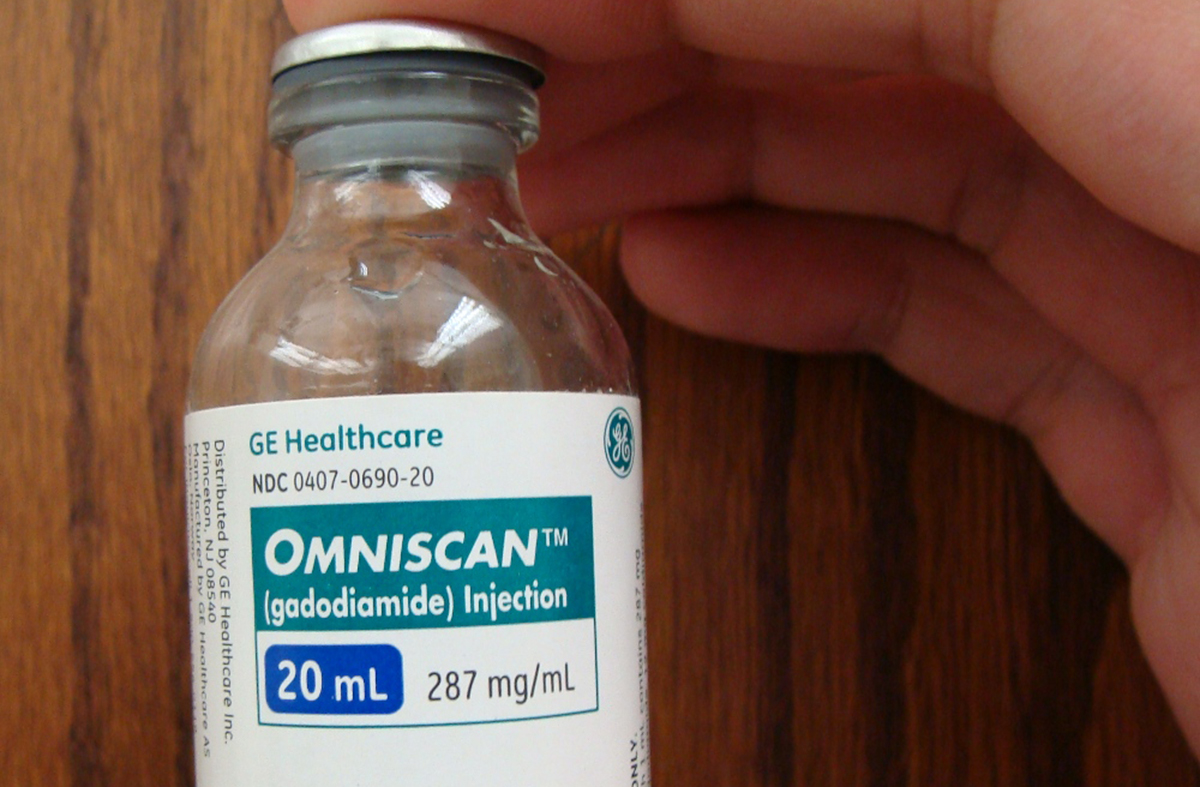
GE Healthcare demande à l’Europe de revoir sa copie. Dans un communiqué publié le 16 mars, le constructeur annonce qu’il a « exercé son droit » à solliciter un réexamen des recommandations émises l’Agence européenne du médicament (EMA) concernant les agents de contraste linéaires au gadolinium. Le 10 mars 2017, son Comité d’évaluation des risques en matière de pharmacovigilance (PRAC) a préconisé le retrait de l’autorisation de mise sur le marché de quatre molécules, dont le gadodiamide (Omniscan®), commercialisé par GE Healthcare.
« Le rapport bénéfice sur risques est positif »
« GE Healthcare reste ferme sur ses convictions basées sur des preuves que le rapport bénéfice sur risque global des agents de contraste linéaires, dont l’Omniscan, est positif », indique le document. Si elle reconnaît qu’une partie du gadolinium reste bien dans le cerveau, l’entreprise souligne qu’ « aucune étude clinique ne prouve le caractère dangereux de ces dépôts ».
Bracco, Guerbet, Bayer
Outre Omniscan®, trois produits sont concernés par la recommandation du PRAC : l’acide gadobénique (MultiHance®), de Bracco, l’acide gadopentétique (Magnevist®), de Bayer et le gadoversétamide (Optimark®), de Guerbet. Dans un communiqué publié le 10 mars, Bracco défend son produit avec les mêmes arguments que GE Healthcare sans indiquer avoir demandé un réexamen. Guerbet, pour sa part, a annoncé ne pas avoir l’intention de demander au PRAC de réexaminer ses recommandations. Au 20 mars 2017, Bayer Pharmaceuticals n’avait pas encore répondu à nos questions.
Le Comité des produits médicaux destinés à l’utilisation humaine puis la Commission européenne
Si le PRAC maintient ces recommandations après réexamen, il les transmettra au Comité des produits médicaux destinés à l’utilisation humaine (CHMP), qui donnera son avis. Elles seront ensuite soumises à la Commission européenne qui prendra – ou non – décision applicable aux membres de l’Union européenne.








Discussion
Aucun commentaire
Commenter cet article