L’Agence nationale de la sécurité du médicament (ANSM) et des produits de santé a relayé les recommandations de l’Agence européenne des médicaments (EMA) concernant les produits de contrastes linéaires à base de gadolinium. Dans une note d’information publiée le 27 mars 2017, elle demande aux prescripteurs de « prendre en compte ces informations avant toute utilisation de produits de contraste dans le cadre des IRM et rappelle qu’il existe des alternatives, notamment de structure macrocyclique, disponibles en quantités suffisantes et qui doivent être utilisées à la dose la plus faible possible et uniquement si nécessaire ».
Recommandation de suspension d’AMM
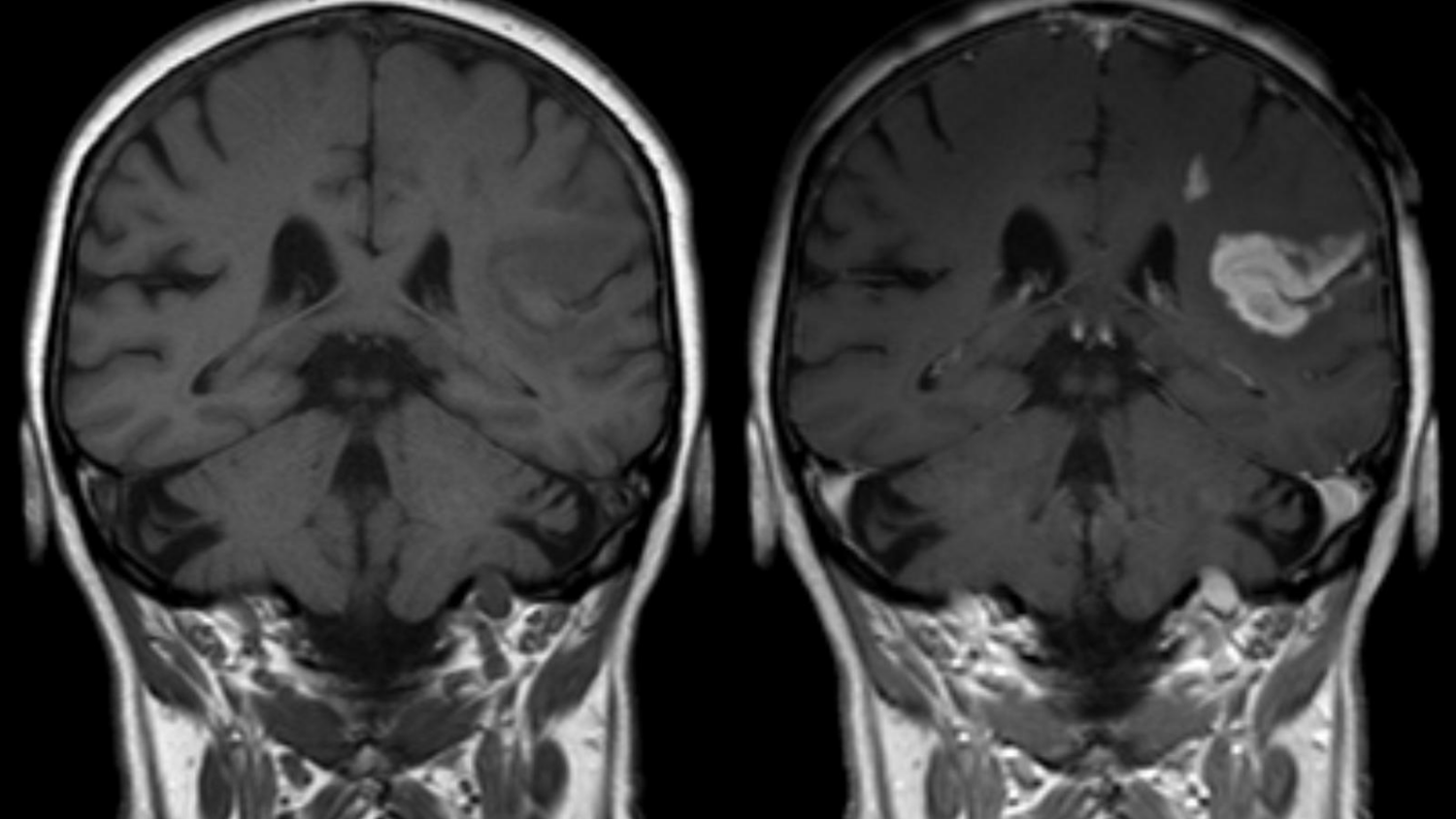
Le du Comité pour l’évaluation des risques en matière de pharmacovigilance (PRAC) de l’EMA a recommandé la suspension de l’autorisation de mise (AMM) sur le marché de quatre produits : le gadodiamide (Omniscan®), le gadoversetamide (Optimark®), le gadopentate (Magnevist®) et l’acide gadobénique (Multihance®). Ces molécules sont des agents de contraste à base de gadolinium de la famille linéaire. Leur suspension est recommandée « en raison de données montrant un dépôt de gadolinium dans le cerveau notamment, sans conséquence clinique rapportée à ce jour », précise l’ANSM.
Deux exceptions
L’ANSM rappelle que les recommandations émises permettent deux exceptions pour les produits linéaires : « l’acide gadoxétique (Primovist®, pas d’AMM en France), utilisé à faibles doses pour l’imagerie du foie et pour lequel il existe très peu d’alternatives, et le gadopentate (Magnevist®) en intra-articulaire dont la concentration en gadolinium est […] environ 200 fois plus faible que pour les produits en intraveineux ».
Un laboratoire demande le réexamen des recommandations
Les recommandations de la PRAC ont été contestées par au moins un laboratoire pharmaceutique. Il s’agit de GE Healthcare, qui annonce avoir « exercé son droit » à solliciter leur réexamen. Guerbet, pour sa part, a pris la décision inverse et annoncé ne pas avoir l’intention de demander au PRAC de revoir sa copie. Dans un communiqué publié le 10 mars, Bracco défend son produit avec les mêmes arguments que GE Healthcare sans indiquer avoir demandé un réexamen. Bayer, enfin, déclare attendre « les recommandations du Comité des médicaments à usage humain ».








Discussion
Aucun commentaire
Commenter cet article