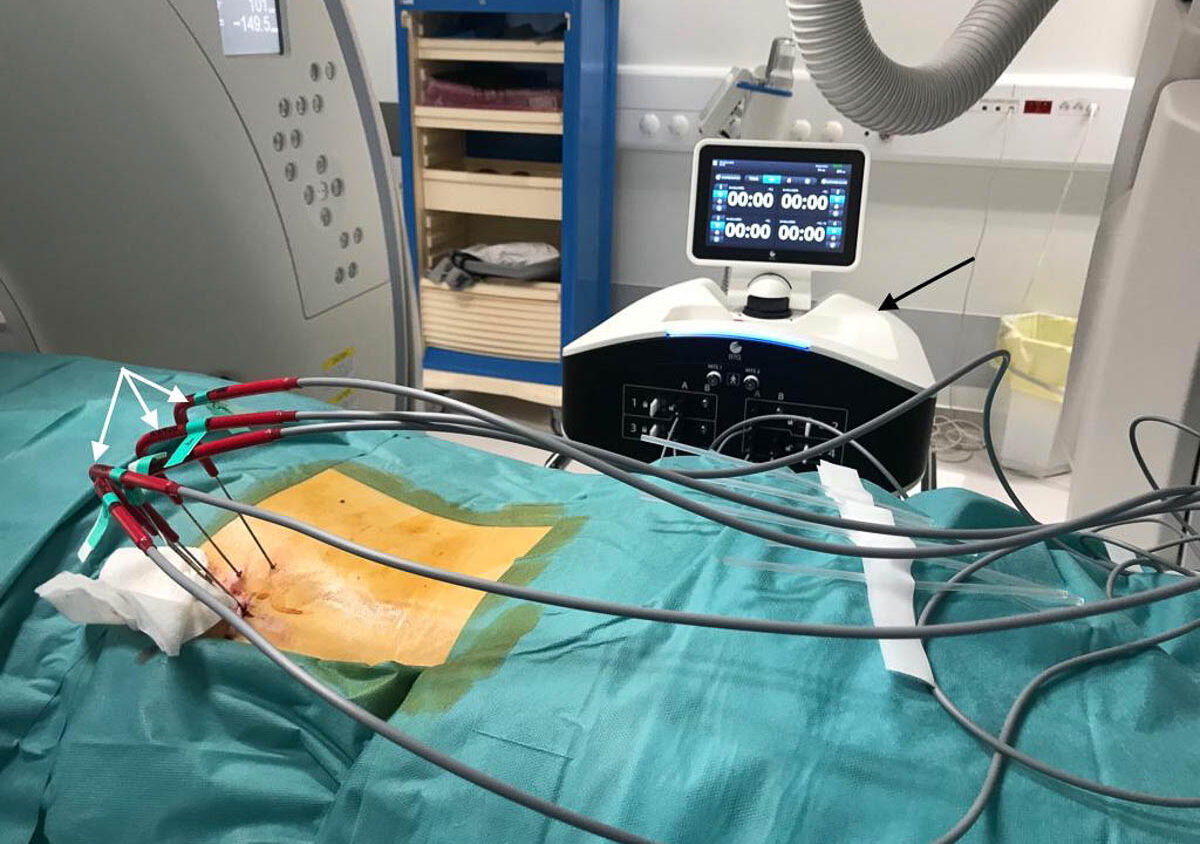
La cryoablation est une méthode de destruction tumorale par le froid. Le glaçon se forme à l’extrémité d’aiguilles de 14 à 17 gauges (G) insérées au sein de la tumeur sous contrôle d’imagerie (scanner, IRM, échographie) (figure 1). La mort cellulaire est obtenue à des températures de - 20 à - 40 °C [1].
Technique
La formation du glaçon à l’extrémité de l’aiguille repose sur l’effet Joule-Thomson : la décompression brutale d’un gaz provoque une chute de température. Les systèmes de cryoablation médicaux actuels utilisent la décompression de l’argon de 245 bars à la pression atmosphérique, qui induit des températures de -110 °C à l’extrémité externe de la sonde (-185 °C à l’intérieur de la sonde). La décompression d’un gaz s’accompagne également d’un espacement des molécules, responsable d’un accroissement de l’énergie cinétique et donc d’un dégagement de chaleur. Pour certains gaz de faible poids atomique, ce dégagement de chaleur est supérieur au refroidissement de l’effet Joule-Thomson







Discussion
Aucun commentaire
Commenter cet article