Introduction
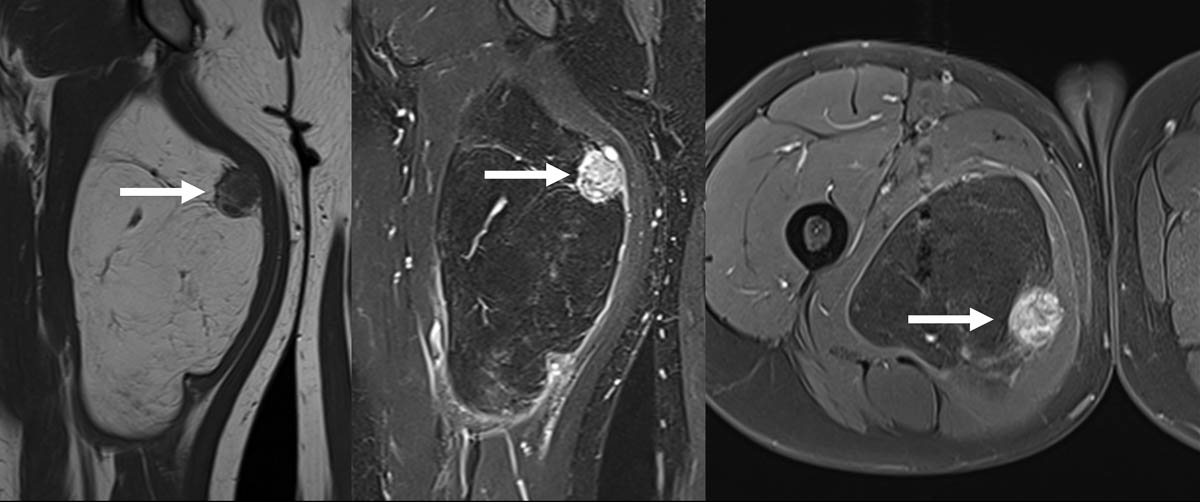
Les tumeurs des tissus mous représentent une gamme hétérogène de lésions bénignes ou malignes. Ces lésions sont regroupées selon différentes catégories, incluant les tumeurs adipeuses (lipomes, liposarcomes), les tumeurs fibroblastiques (tumeurs desmoides…), les tumeurs des gaines nerveuses périphériques (schwannome, tumeur maligne des gaines nerveuses périphériques…), etc. De nombreuses formations peuvent également simuler un aspect de tumeur (« pseudo-tumeurs »), par exemple les abcès, les dépôts microcristallins, les hématomes, etc. Le contexte sera alors essentiel pour orienter vers le diagnostic.
Les sarcomes des tissus mous sont rares
Les sarcomes sont des tumeurs malignes rares d’origine mésenchymateuse, développées à partir du tissu conjonctif ou de ses dérivés (os, cartilage, graisse, vaisseaux, etc.). Ils touchent majoritairement les tissus mous (60 %), les viscères (30 %) puis les os (10 %) [1].
L’Organisation mondiale de la santé (OMS) a publié en 2020 la 5e éditio
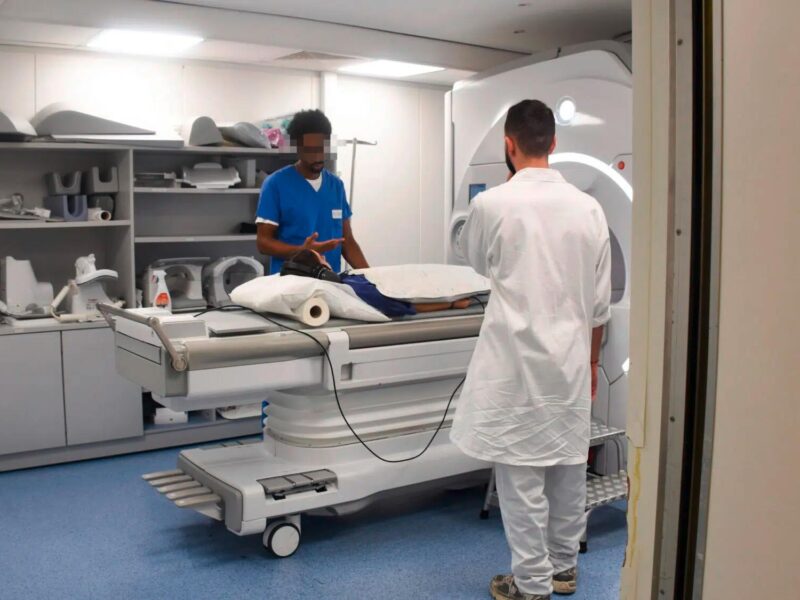
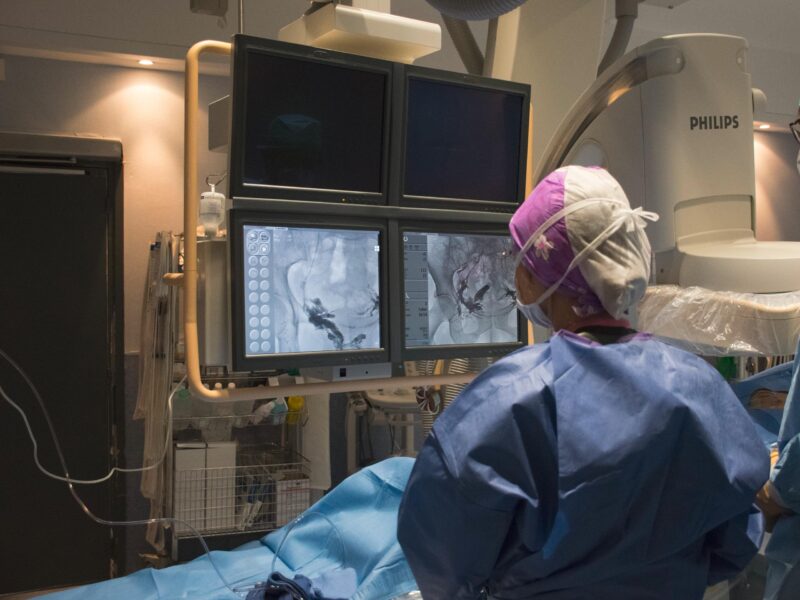
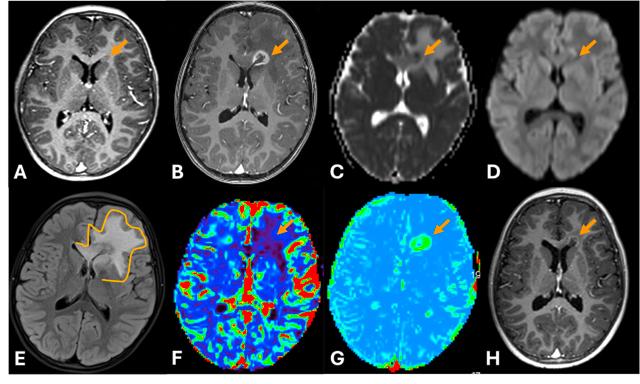









Discussion
Aucun commentaire
Commenter cet article