Introduction
Définition
Le premier épisode psychotique (PEP) est défini par la survenue initiale de délires, d’hallucinations ou d’une désorganisation psychique de grande intensité, d’une durée supérieure à 7 jours [1]. L’incidence du PEP varie de 10 à 47 pour 100 000 habitants par an, selon les études [2],[3]. Son évolution est variable et difficile à prédire. Le PEP peut rester isolé, récidiver ou évoluer secondairement vers un trouble schizo-affectif [4],[6]. Le traitement précoce du PEP est l’un des facteurs majeurs influençant le pronostic à long terme [7],[10]. Une meilleure compréhension de la physiopathologie du PEP, une sélection adéquate des patients pour un traitement optimal, et une pronostication appropriée de l’évolution de la maladie représentent des défis réels pour la recherche actuelle.
La stratégie diagnostique en imagerie
La stratégie diagnostique optimale pour les patients souffrant de troubles psychiatriques, y compris ceux présentant un PEP, n’a pas encore été clairement établie. Une étude récente examinant le bénéfice médico-économique de diverses techniques d’imagerie, telles que la tomographie par émission de positrons (TEP), la tomographie par émission monophotonique (TEMP), l’imagerie par résonance magnétique (IRM) structurelle et l’IRM fonctionnelle au repos, dans la gestion des troubles psychiatriques a révélé que l’IRM et la TEP étaient les plus adaptées, avec le coût le plus bas et la précision diagnostique la plus élevée [11]. L’IRM est désormais devenue la référence en imagerie des troubles psychiatriques, montrant des anomalies structurelles chez 1 à 60 % des patients, entraînant un redressement du diagnostic initial dans 1 à 20 % des cas [12],[13].
En plus de permettre l’exclusion de nombreux diagnostics différentiels neurologiques pouvant se révéler par des manifestations psychiatriques, les techniques d’imagerie avancées jouent un rôle dans l’identification des biomarqueurs d’imagerie des troubles psychiatriques, la sélection des patients pour un traitement optimal et le suivi des effets du traitement [14],[15]. Compte tenu des problèmes spécifiques posés par le PEP, la contribution de l’imagerie avancée à la gestion de cette pathologie est un enjeu particulièrement important.
Techniques avancées d’IRM
Il existe plusieurs techniques avancées d’IRM pour l’imagerie structurelle et fonctionnelle cérébrale. Par exemple, de nouvelles techniques d’IRM quantitative issues des séquences pondérées en T1 permettent d’évaluer l’anatomie de plus en plus précisément. En parallèle, certaines séquences permettent l’évaluation de paramètres physiologiques ou moléculaires. C’est le cas de l’IRM fonctionnelle, qui évalue l’activation neuronale de manière indirecte en mesurant les différences de concentration en désoxyhémoglobine dans les veines des régions cérébrales actives, de la spectroscopie, qui évalue le profil moléculaire des voxels étudiés, ou encore de l’Arterial Spin Labelling (ASL), qui informe sur la distribution des protons artériels précédemment activés par des ondes de radiofréquences.
Nous avons réalisé une revue systématique de la littérature afin de déterminer comment l’imagerie avancée dans le cadre d’un PEP peut permettre d’accroître la spécificité diagnostique et de prédire l’évolution de la maladie.
Matériels et méthodes
Cette revue systématique a été réalisée conformément aux directives PRISMA (Preferred Reporting Items for Systematic Reviews and Meta-Analyses). Les recherches dans PubMed ont été effectuées le 9 décembre 2022 en utilisant des combinaisons des termes de recherche prédéterminés suivants : « premier épisode psychotique » et « imagerie avancée » ou « IRM fonctionnelle », ou « IRM de repos » ou « spectroscopie » ou « ASL » ou « DTI » ou « imagerie de diffusion », avec les filtres « Essai clinique », « Méta-analyse » et « Essai contrôlé randomisé ». Une revue manuelle des références a été réalisée. Les études ont été incluses si elles décrivaient des techniques d’imagerie structurelle et/ou fonctionnelle chez des patients ayant un diagnostic de PEP. Les études ont été exclues si leur objectif était lié aux traitements ou si elles étaient basées sur l’apprentissage automatique. Les études ont été extraites par un seul auteur et classées en fonction des méthodes d’imagerie utilisées.
Résultats
IRM quantitative issue des séquences pondérées en T1
Le processus de sélection des études est illustré par la figure 1.
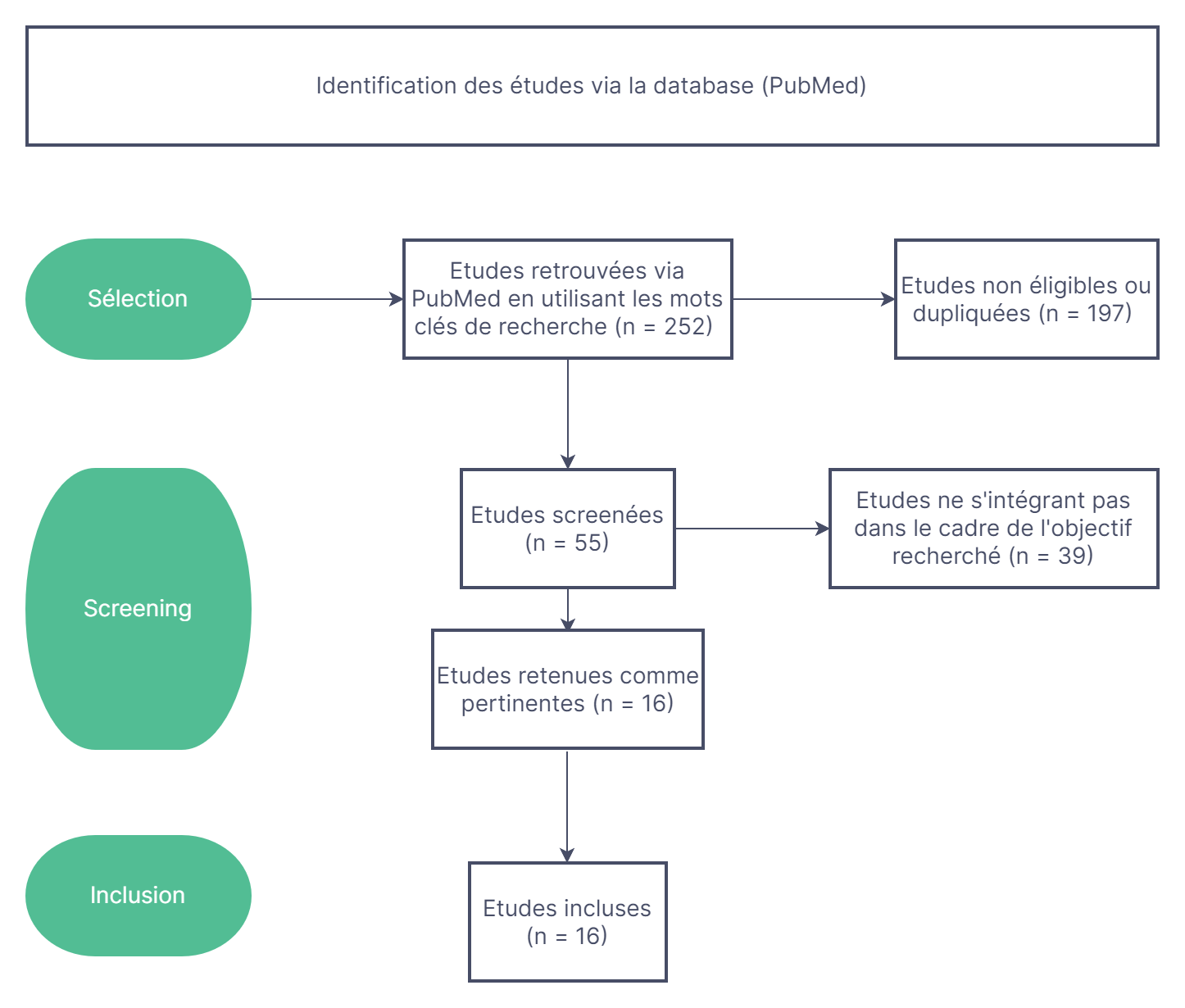
Figure 1. Flowchart illustrant le mode de sélection des études pour cette revue.D. R.
Analyse des anomalies cérébrales dans le PEP
Les différentes études ont révélé comme principales anomalies des réductions de volume de substance grise, un élargissement en taille des ventricules et une réduction du volume cérébral global dans le PEP [16]. Les techniques avancées peuvent permettre une analyse structurelle plus précise que celle effectuée uniquement par l’œil du radiologue dans la pratique clinique courante.
La morphologie est généralement évaluée à l’aide de l’IRM volumétrique pondérée en T1 avec des méthodes automatisées informatisées. Les techniques d’IRM quantitative issues des séquences pondérées en T1 permettent une mesure fine de la structure cérébrale, examinant l’ensemble du cerveau et détectant de petites différences régionales dans la concentration et le volume de la substance grise ou blanche [17]. Les patients présentant un PEP montrent un amincissement de certaines régions corticales, notamment celles impliquées dans le traitement émotionnel et les fonctions exécutives supérieures.
Changements morphologiques observés
Une méta-analyse de 965 patients admis pour PEP a révélé une diminution du volume de la substance grise dans les régions insulaires et fronto-operculaires, le gyrus temporal supérieur, ainsi que dans le cortex frontal médian et cingulaire antérieur par rapport à une population témoin [18].
Zhao et al. (2022) ont observé, dans une grande cohorte de 2 765 sujets, un amincissement cortical dans le cortex temporal supérieur latéral droit, le cortex cingulaire antérieur droit et l’insula droite chez les patients avec PEP comparés aux témoins sains [19].
Prasad et al. (2004) ont examiné la morphologie du gyrus parahippocampique chez des sujets naïfs de neuroleptiques avec PEP, montrant que les patients avec des délires possédaient un gyrus parahippocampique relativement plus petit comparé aux sujets non délirants [20].
Ces changements morphologiques semblent augmenter avec le temps après le PEP chez les patients développant une psychose chronique secondaire, ce qui pourrait indiquer des altérations progressives de la matière grise.
Un amincissement cortical plus important dans l’insula droite, le cortex frontal inférieur droit, le cortex temporal latéral gauche et le pôle temporal droit a été observé chez les patients avec schizophrénie à long terme comparé aux individus avec PEP [19].
Des réductions accélérées de l’épaisseur corticale liées à l’âge ont été quantifiées dans le cortex temporal moyen bilatéral et le cortex orbito-frontal droit, suggérant une réduction progressive de la matière grise durant la transition vers la psychose.
Réduction du volume cérébral dans le PEP
Ces résultats concordent avec ceux d’une autre grande étude de Takahashi et al. (2009), qui a analysé les volumes des sous-régions temporales supérieures à l’IRM initiale (baseline) et à l’IRM de suivi (moyenne : 1,8 ans) chez 70 patients : 25 individus à très haut risque (dont 12 ont développé une psychose [UHRP] et 23 non [UHRNP]), 23 patients avec PEP et 22 sujets témoins. Seul le groupe « PEP » avait un planum temporale et un gyrus temporal supérieur caudal significativement plus petits que les autres groupes à la baseline. En comparaison longitudinale, les patients UHRP et PEP ont montré une réduction significative de la matière grise (entre 2 % et 6 % par an) dans le planum polare, le planum temporale et la région caudale par rapport aux témoins et/ou aux sujets UHRNP [21].
En revanche, bien que la perte de volume cortical semble être un marqueur des troubles psychotiques, elle ne semble pas pointer vers une étiologie spécifique. Palaniyappan et al. (2016) ont réalisé une revue de la précision de l’IRM quantitative issue des séquences pondérées en T1 pour déterminer si elle pouvait aider à différencier la schizophrénie d’autres types de psychose chez des participants ayant reçu un diagnostic clinique de PEP. Après avoir inclus quatre études totalisant 275 participants avec PEP, il n’a pas été mis en évidence d’anomalie spécifique de diagnostic de schizophrénie par rapport à d’autres troubles psychotiques en utilisant l’IRM quantitative issue des séquences pondérées en T1 [22].
Les résultats des études structurelles sont résumés dans le tableau 1.
| Étude | Nombre de patients | Résultats principaux |
| Zhao et al. 2022 | 2 675 (859 UHR, 671 PEP, 579 schizophrènes, 566 contrôles) | Amincissement cortical du cortex temporal supérieur latéral droit, cingulaire antérieur droit et insulaire droit. |
| Takahashi et al. 2009 | 80 (35 UHR, 23 PEP, 22 contrôles) | Volumes des subrégions temporales supérieures mesurées au baseline et au suivi (1,8 ans) : seul le groupe PEP présentait un planum temporale et un gyrus temporal supérieur caudal significativement plus petits que les autres groupes au baseline. Sur le suivi longitudinal, les patients UHRP et PEP montraient une réduction significative du volume de matière grise (2 à 6 % par an) dans le planum temporale, planum polare et la région caudale comparativement aux sujets contrôle et UHRNP. |
| Radua et al. 2012 | 2 005 (965 PEP, 1 040 contrôles) | Diminutions de volume bilatérales de la substance grise dans l’insula, l’opercule et les gyrus temporaux supérieurs, ainsi que le cortex cingulaire antérieur et médial frontal. Relative augmentation de volume du gyrus lingual droit et du gyrus précentral gauche comparativement aux sujets contrôles. |
| Prasad et al. 2004 | 87 (44 PEP, 33 troubles schizo-affectifs et 11 troubles psychotiques non schizo – 43 contrôles) | Les patients avec illusions présentaient un gyrus parahippocampique relativement plus petit que les sujets sans illusions. |
| Pariante et al. 2005 | 156 (78 PEP, 78 contrôles) | Augmentation de taille de la glande pituitaire. |
| Palaniyappan et al. 2016 | 275 PEP | Pas d’argument en faveur du diagnostic de schizophrénie en comparaison avec les autres troubles psychotiques dans le pattern de modifications cérébrales vues en voxel-based morphometry. |
IRM fonctionnelle
Cartographie des réseaux cérébraux au repos
L’IRM fonctionnelle (fMRI) est basée sur le contraste BOLD (Blood Oxygen Level Dependent), qui utilise les propriétés paramagnétiques de l’hémoglobine désoxygénée, durant des paradigmes d’activation par tâche ou au repos. L’activité neuronale est associée à des changements dans la consommation d’oxygène et donc dans la concentration de désoxyhémoglobine. Les corrélations entre les séries temporelles du signal BOLD de régions cérébrales distantes reflètent leurs interactions fonctionnelles, permettant ainsi l’identification de différents réseaux fonctionnels de repos (RSN).
L’un des principaux RSN activés au repos, c’est-à-dire en l’absence de toute action spécifique, est le Réseau du Mode Par Défaut (DMN). Dans des conditions physiologiques, le DMN est désactivé lors de l’exécution de tâches orientées vers un but. Le Réseau Exécutif Central (CEN) et le DMN sont donc négativement corrélés [23],[24]. Le Réseau de Salience (SN) est théorisé pour médiatiser le passage entre eux [25].
Altérations fonctionnelles dans le PEP
Dans le PEP, des altérations de l’imagerie fonctionnelle ont été décrites, telles que la déconnexion au sein du DMN, du SN et du CEN, à des degrés divers. Les perturbations les plus notables étaient l’hypoconnectivité au sein du DMN, et entre le SN et le DMN [26].
Des activations anormales ont été particulièrement mises en évidence dans des régions faisant partie du système limbique, impliqué dans nos réponses comportementales et émotionnelles. Une méta-analyse de 362 patients avec PEP réalisée par Radua et al. (2012) a montré une hypoactivation dans la partie antérieure de l’insula droite, dans les cortex cingulaires antérieurs dorsaux et dans le précunéus gauche durant les tâches cognitives [18].
Ces données ont été corroborées par Soldevila-Matias et al. (2022), qui ont trouvé une hypoactivation dans le précunéus gauche, l’insula et le striatum bilatéral durant les tâches cognitives [27], ainsi que par Lukow et al. (2021), qui ont examiné les études en IRM fonctionnelle utilisant des paradigmes de traitement émotionnel chez des patients avec PEP, montrant une réponse neuronale diminuée aux émotions dans l’amygdale et le cortex cingulaire antérieur [28].
Une autre étude de Radua et al. (2015) a observé une hypoactivation bilatérale du striatum ventral durant l’anticipation et le retour d’information sur les récompenses chez les patients atteints de psychose [29].
L’expérience délirante comme symptôme chez les patients avec PEP
Inversement, certaines études ont montré une hyperactivation ou une réduction relative de la désactivation de certaines régions cérébrales chez les patients avec PEP. Radua et al. (2012) ont observé, durant les tâches cognitives, une activation plus importante dans les noyaux gris centraux droits et le thalamus s’étendant à la partie postérieure de l’insula, ainsi que dans le cortex frontal médian, les gyrus frontal inférieur droit et précentral gauche [18].
Shafritz et al. (2019) ont utilisé une tâche de conflit de réponse simple : les patients devaient appuyer sur un bouton de réponse du même côté ou du côté opposé à un cercle qui apparaissait. Cette étude a montré une réduction de la désactivation dans le cortex cingulaire antérieur et le sillon intrapariétal chez les patients avec PEP [30].
Le délire est un symptôme fréquent de la psychose, apparaissant chez la majorité des patients avec un PEP. Raji et al. (2018) ont montré que les patients avec des expériences délirantes avaient une activation plus forte du striatum ventral dans les deux hémisphères par rapport aux patients sans expériences délirantes [31].
Les résultats des études fonctionnelles sont résumés dans le tableau 2.
| Étude | Nombre de patients | Résultats principaux |
| Soldevilla-Matias et al. 2022 | 1 167 (598 PEP, 567 contrôles) | Hypoactivation de l’insula antérieure gauche, du précunéus et du striatum bilatéral durant les tâches cognitives. |
| Shafritz et al. 2019 | 66 (33 PEP, 33 contrôles) | Hyperactivation du cortex cingulaire antérieur et du sillon intra-pariétal. |
| Raij et al. 2018 | 13 PEP | Expériences illusoires associées à une plus grande activation du striatum ventral dans les deux hémisphères. |
| Radua et al. 2012 | 765 (362 PEP, 403 contrôles) | Hypoactivation de la partie antérieure de l’insula droit, des cortex cingulaires antérieurs dorsaux et du précunéus gauche. Relative réduction de l’hypoactivation du thalamus et des noyaux gris centraux gauches étendue à la partie postérieure de l’insula et au cortex frontal médial, au cortex frontal inférieur droit et au gyrus précentral gauche. |
| Radua et al. 2015 | 917 | Hypoactivation striatale ventrale bilatérale durant les phases d’anticipation et de feedback. |
| O’Neill et al. 2019 | 946 (420 PEP, 526 contrôles) | Les Mode par défaut (DMN), Réseau de salience (SN) et Réseau central exécutif (CEN) montraient tous une combinaison d’hypo- et d’hyperconnectivité, à différents degrés, quoique la perturbation la plus notable fut l’hypoconnectivité du DMN et entre le SN et le DMN. |
| Lukow et al. 2021 | 121 (48 PEP, 73 contrôles) | Diminution des réponses neurales à l’émotion, en particulier dans l’amygdale et le cortex cingulaire antérieur. |
Autres séquences avancées
Les séquences de spectroscopie par résonance magnétique permettent de différencier divers métabolites en fonction de leur fréquence de résonance et d’évaluer leur concentration. Cette dernière peut varier dans les troubles psychiatriques. En particulier, une diminution du N-acétyl-aspartate (NAA), principal marqueur neuro-axonal, a été démontrée dans les lobes frontaux et temporaux ainsi que dans le thalamus chez les patients atteints de PEP [32],[33].
Sydnor et al. (2020) et Nakahara et al. (2022) ont tenté de mesurer le glutamate (Glu), la glutamine (Gln), le glutamate + glutamine (Glx), l’acide gamma-aminobutyrique (GABA) et le glutathion (GSH) chez des patients atteints de psychose, mais ces études ne retrouvaient pas de résultats concluants [34],[35].
D’autres séquences d’imagerie avancées basées sur l’IRM sont désormais disponibles. La perfusion cérébrale peut être évaluée quantitativement sans contraste intraveineux grâce à la technique de marquage des spins artériels (ASL), qui permet de mesurer le flux sanguin cérébral (CBF). En utilisant cette technique non invasive, Percie du Sert et al. (2022) ont montré une diminution du CBF dans les gyrus frontal supérieur gauche, frontal moyen et occipital moyen droits, ainsi qu’une augmentation du CBF dans le putamen gauche chez les patients atteints de PEP par rapport aux témoins sains [36].
Ces résultats sont résumés dans le tableau 3.
| Étude | Nombre de patients | Résultats principaux |
| Whitehurst et al. 2020 | 2339 | Concentrations de NAA plus faibles dans le lobe frontal et le thalamus chez les PEP comparativement aux contrôles. |
| Sydnor et al. 2020 | 548 (255 avec troubles psychiatriques, 121 PEP, 93 contrôles) | Concentrations de glutamate et de glutathion significativement plus faibles. Pas de différence significative pour la glutamine, le complexe glutamate-glutamine et le GABA. |
| Nakahara et al. 2022 | 16 737 (7 993 UHR, PEP et schizophrènes, 8 744 contrôles) | Complexe glutamate-glutamine élevé dans les noyaux gris centraux. Baisse du GABA dans le cortex cingulaire médial. |
| Percie du Sert et al. 2012 | 827 (426 PEP, 401 contrôles) | Hypoperfusion des gyrus frontaux moyen et supérieur gauches et du gyrus occipital médial droit. Hyperperfusion du putamen gauche. |
Discussion
Modifications neuroanatomiques chez les patients atteints de PEP
Les analyses structurelles ont révélé des modifications du volume de la matière grise et un amincissement cortical chez les patients atteints d’un PEP, en particulier dans l’insula, l’opercule, le gyrus temporal supérieur ainsi que dans le cortex frontal médian et cingulaire antérieur. Des réponses cérébrales altérées ont été observées dans ces mêmes régions en IRM fonctionnelle. Certaines études ont montré une réduction progressive du volume au cours de la transition vers la psychose [19],[21], suggérant des altérations neuroanatomiques progressives après le début de la maladie. Le niveau de NAA, un marqueur du métabolisme neuronal, est réduit dans le cortex frontal et le thalamus chez les patients atteints de PEP, ainsi que dans de nombreuses zones corticales et de la substance blanche chez les patients atteints de schizophrénie chronique [33].
Prédire l’évolution d’un PEP
Ces résultats suggèrent que la schizophrénie est associée à une diminution de l’activité métabolique neuronale affectant davantage de régions cérébrales à mesure que le trouble progresse. Ces observations soulignent l’importance d’une intervention précoce pendant ou avant le PEP [16]. La capacité à prédire l’évolution d’un PEP, qui peut rester isolé, réapparaître ou évoluer vers un trouble schizo-affectif, constituerait une avancée majeure. Une étude a tenté de différencier la schizophrénie des autres types de psychose dans les PEP, mais n’a pas trouvé de preuves soutenant le diagnostic de schizophrénie en utilisant le schéma de modifications cérébrales observées dans les études de morphométrie basée sur les voxels chez 275 patients atteints de PEP. Les techniques avancées d’IRM, notamment l’imagerie fonctionnelle, pourraient améliorer la spécificité diagnostique et jouer un rôle prédictif, en particulier dans l’évaluation de la réponse au traitement.
Évaluation de la réponse au traitement
Bien que l’objectif de cette revue n’inclue pas une discussion sur le traitement, certaines des références étudiées ont évalué la réponse au traitement comme objectif secondaire. Par exemple, Shafritz et al. (2019) ont observé qu’une activation de base plus importante du cortex cingulaire antérieur, de la jonction temporo-pariétale et du cortex temporal supérieur prédisait une réduction plus importante des symptômes et une meilleure réponse thérapeutique après traitement [30]. Utilisant la spectroscopie, Nakahara et al. (2022) ont observé que les patients atteints de schizophrénie résistante au traitement présentaient des niveaux élevés de Glutamine et de Glutamate dans le cortex cingulaire médian [34].
D’autres séquences d’imagerie avancées basées sur l’IRM, non discutées dans cette revue, existent et pourraient jouer un rôle utile à l’avenir. La connectivité structurelle peut être évaluée par tractographie, en utilisant l’imagerie par tenseur de diffusion (DTI) ou l’imagerie de diffusion à haute résolution angulaire (HARDI). Néanmoins, cette évaluation reste mal caractérisée dans les cas de PEP. La neuromélanine, présente dans les neurones dopaminergiques de la substance noire et les neurones noradrénergiques du locus coeruleus, est un pigment ayant des propriétés paramagnétiques et apparaît hyperintense sur les images IRM pondérées en T1. Le développement de séquences sensibles à la neuromélanine pourrait désormais permettre une mesure indirecte non invasive de la fonction dopaminergique, qui pourrait être notablement modifiée dans la schizophrénie [37],[38].
Développement d’une séquence à l’IRM 7 T
Une séquence IRM a récemment été développée à ultra-haut champ magnétique (7 teslas) pour étudier la distribution cérébrale du lithium. Cette séquence semble intéressante pour le suivi des troubles bipolaires, dont le traitement actuel repose sur des médicaments à base de lithium, dont le mécanisme d’action reste mal compris [39].
Il faut également reconnaître les difficultés liées à la réalisation de techniques d’imagerie avancées lors d’un premier épisode psychotique. La décision d’imager un patient doit résulter d’une communication appropriée entre le psychiatre et le radiologue. La demande d’examen IRM doit donc inclure des informations cliniques précises et détaillées afin de permettre au neuroradiologue d’optimiser le protocole d’imagerie. Le patient doit être accompagné de manière proactive sur ce à quoi s’attendre lors de l’examen et peut être accompagné d’un membre de l’équipe de soins psychiatriques.
Limites de la revue
Notre revue présente des limites, notamment une hétérogénéité méthodologique considérable dans les études incluses. De plus, le délai entre l’apparition des symptômes et l’IRM est mal décrit. Par ailleurs, le traitement antipsychotique n’a été utilisé que chez certains patients, ce qui rend impossible la distinction entre l’effet de la maladie et celui du traitement. En outre, les études structurelles et fonctionnelles rapportées présentent des limitations communes, car elles traitent toutes de comparaisons de groupe, ce qui rend impossible l’exploration d’un sujet à l’échelle individuelle.
Une IA en cours de développement pour le diagnostic
L’intelligence artificielle (IA), via l’apprentissage supervisé et non supervisé, est actuellement en cours de développement, avec l’espoir qu’elle puisse aider au diagnostic et jouer un rôle dans la médecine personnalisée et de précision. Les recherches en IA sont principalement effectuées par apprentissage supervisé utilisant la méthode SVM (support vector machine), ce qui signifie qu’un programme logiciel est formé pour classer les sujets selon des groupes prédéterminés par des experts. Cette méthode SVM permet une classification de qualité pour de nombreuses pathologies neurologiques et psychiatriques [40]. La valeur de l’apprentissage automatique dans la prédiction du risque au niveau individuel dans une population à risque de développer une pathologie psychiatrique a été étudiée. Une étude utilisant le SVM pour prédire l’évolution clinique à 6 ans du PEP a démontré une sensibilité de 71 % et une spécificité allant de 61 % à 68 % [41]. Plus récemment, le SVM a été utilisé pour prédire la réponse thérapeutique. Ces modèles utilisent les données d’imagerie collectées avant le début du traitement comme base dans la phase d’apprentissage, tandis que les études de suivi permettent de différencier les répondeurs des non-répondeurs [42].
Les performances de l’apprentissage automatique continueront probablement à s’améliorer grâce à une combinaison d’améliorations des modèles et à l’inclusion accrue de biomarqueurs supplémentaires, tels que des marqueurs moléculaires, génétiques, transcriptomiques et pharmacologiques.









Discussion
Aucun commentaire
Commenter cet article