Introduction
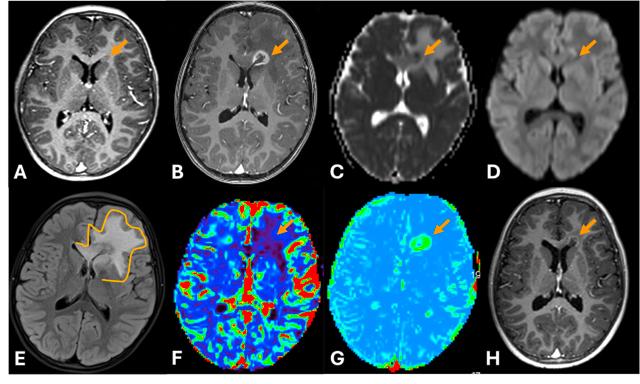
Les tumeurs malignes du système nerveux central sont les cancers solides les plus fréquents de la population pédiatrique [1]. Le taux d’incidence brut global des tumeurs cérébrales est de 4,3 pour 100 000 personnes et par an, ce qui représente environ 400 nouveaux cas par an en France. Les principales catégories histologiques sont les tumeurs neuro-épithéliales (73 %) incluant les gliomes (43 %), les tumeurs neuronales et glio-neuronales (12 %), et embryonnaires (15 %). Le reste est en rapport avec des tumeurs des méninges, mésenchymateuses, des racines paravertébrales et des nerfs crâniens, des tumeurs germinales et les craniopharyngiomes [2]. L’âge est un facteur important avec des prédominances histologiques particulières, notamment avant 4 ans et après 15 ans. Elles sont classées selon la classification de l’organisation mondiale de la santé (OMS) 2021 [3] en fonction des caractéristiques histologiques et de biologie moléculaire.
L’imagerie occupe une place centrale dans










Discussion
Aucun commentaire
Commenter cet article