Le comité d’évaluation des risques et de pharmacovigilance (PRAC) va revoir sa copie sur les produits de contraste gadolinés. Dans un article publié le 7 avril sur son site internet, cet organisme, composante de l’Agence européenne du médicament (EMA), annonce en effet qu’il s’apprête à réexaminer les éléments qui l’ont conduit à recommander une suspension de l’autorisation de mise sur le marché (AMM) des agents linéaires à base de gadolinium.
Une demande des industriels
Cette seconde lecture intervient « à la demande de certains détenteurs de cette AMM », précise le PRAC, ainsi que le permet le droit européen dans ce genre de procédure. Parmi ceux-ci, GE Healthcare avait fait part de son intention « d’exercer son droit » dans un communiqué diffusé le 16 mars.
Le principe de précaution
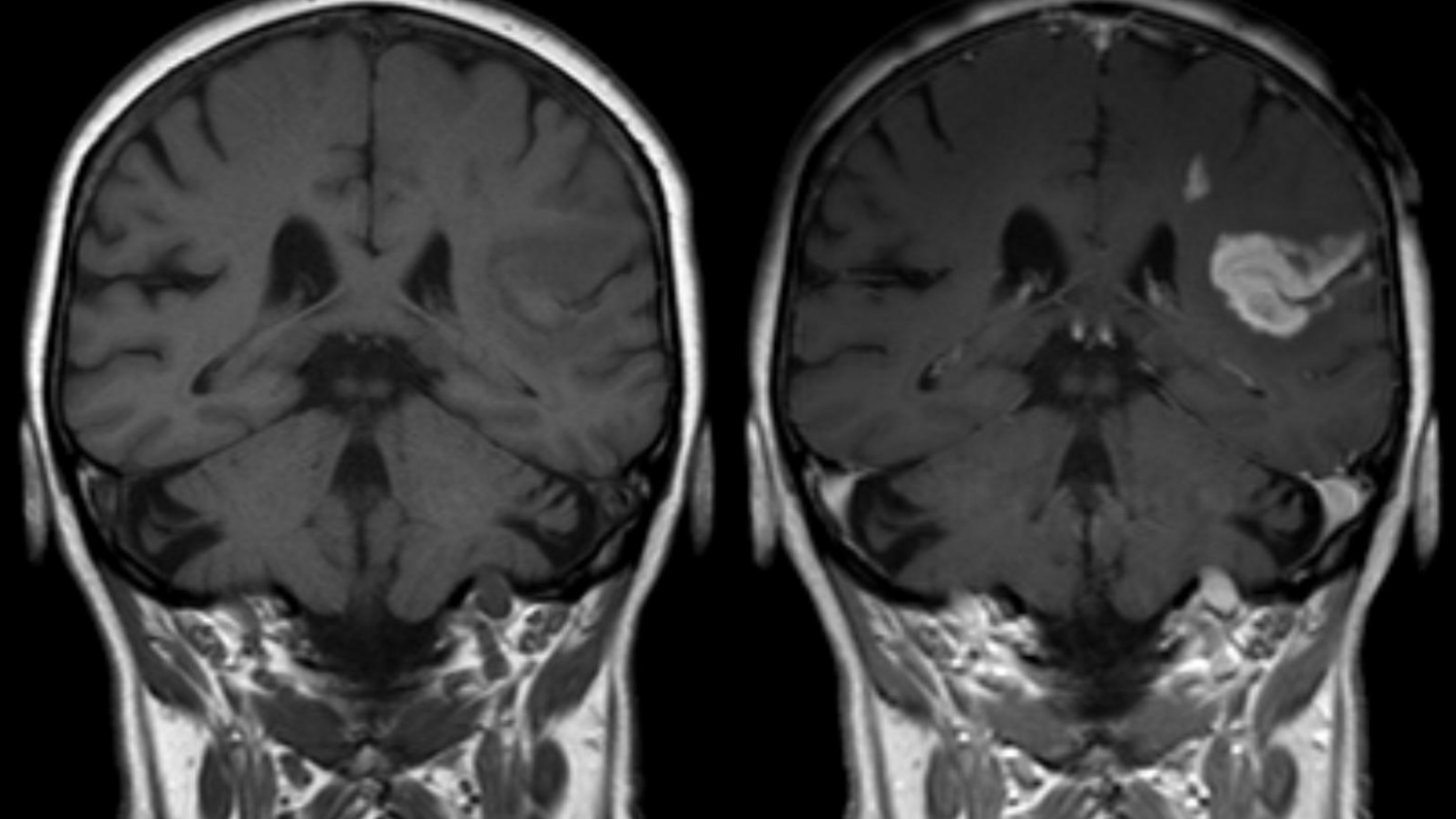
Le PRAC a émis ses premières recommandations le 10 mars dernier. Dans un communiqué diffusé à cette occasion, il justifie cette décision par l’existence de « preuves convaincantes de l’accumulation de gadolinium dans le cerveau ». S’il reconnaît qu’aucun signe pathologique corrélé à cette accumulation n’a été relevé, il invoque le principe de précaution. Les préconisations concernent trois agents de contraste linéaires : l’acide gadobénique (MultiHance®), le gadodiamide (Omniscan®), l’acide gadopentétique (Magnevist®) et le gadoversétamide (Optimark®).
Résultats en juillet
Les résultats du réexamen seront connus en juillet, annonce le PRAC. S’il maintient ses recommandations, il les transmettra pour avis au Comité des produits médicaux destinés à l’utilisation humaine (CHMP). Elles seront ensuite soumises à la Commission européenne, qui pourrait prendre une décision applicable aux membres de l’Union européenne.










Discussion
Aucun commentaire
Commenter cet article