Contexte
La nécessité de définir une prise en charge adaptée
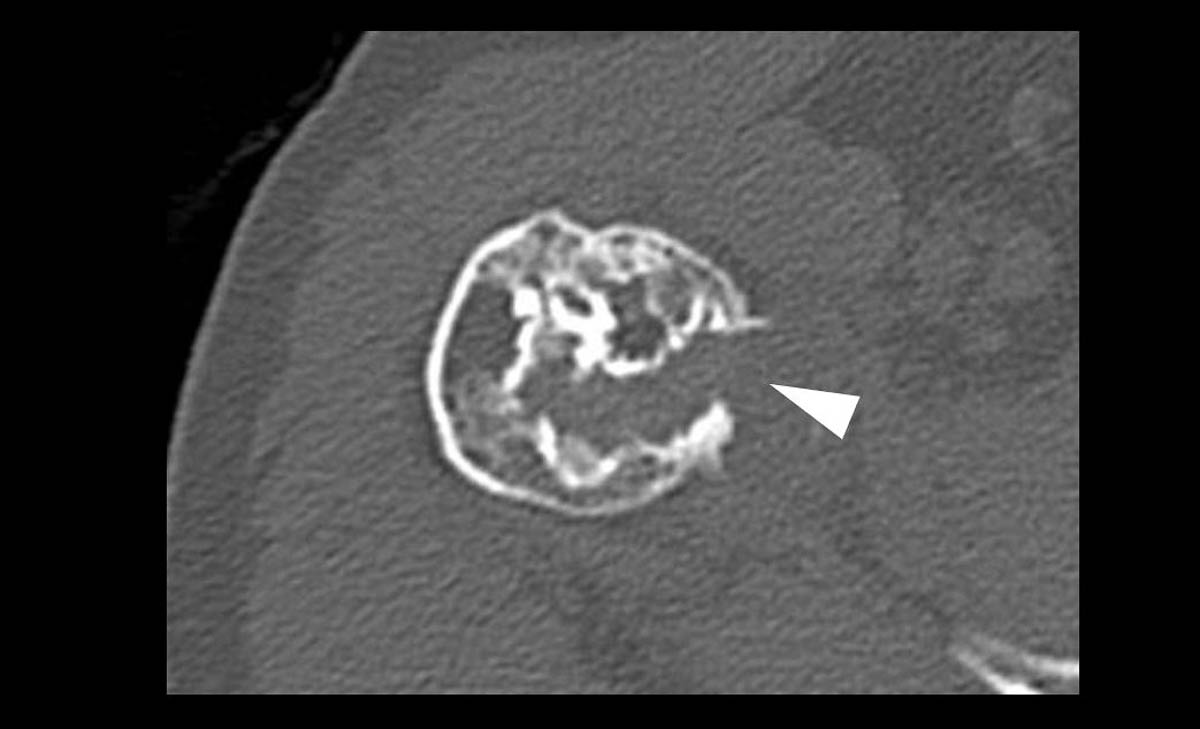
Les lésions osseuses focales (LOF) sont fréquentes, mais il y a une grande disparité de prévalence entre les tumeurs bénignes et pseudo-lésions (très fréquentes) et les tumeurs malignes (rares) [1, 2]. Le problème est que les tumeurs osseuses malignes ou bénignes mais localement agressives nécessitent une prise en charge particulière, passant souvent par une chirurgie carcinologique qui doit être réalisée dans un centre expert (réseau NETSARC + en France) avec une approche multidisciplinaire (e.g., concertation entre chirurgiens, radiologues, radiothérapeutes et anatomopathologistes) [3]. En effet, les patients porteurs d’une tumeur osseuse maligne pris en charge en dehors d’un centre spécialisé ont un moins bon pronostic et une survie diminuée comparés aux patients pris en charge en centre spécialisé. Inversement, les lésions osseuses bénignes et les pseudo-lésions nécessitent une prise en charge moins invasive, pas forcément









Discussion
Aucun commentaire
Commenter cet article