Introduction
La neuropathie optique ischémique antérieure aiguë (NOIA) est la neuropathie optique aiguë la plus fréquente chez les patients âgés de plus de 50 ans. Son incidence est de 2 à 10 / 100 000 patients par an [1]. Elle résulte d’une ischémie de la tête du nerf optique et de la neurorétine et entraîne un handicap visuel ou une malvoyance. Elle peut être due à la maladie de Horton qui est une artérite à cellules géantes, ou à des troubles circulatoires dans le cas de la forme non artéritique. Une détermination rapide de l’étiologie est cruciale puisqu’une corticothérapie doit être instaurée en urgence en cas de suspicion de maladie de Horton, tandis qu’elle ne sera pas systématique dans les formes non artéritiques [2]. Les corticoïdes permettent de limiter le risque de bilatéralisation, avec un effet débattu sur la récupération visuelle. Le diagnostic de maladie de Horton n’est pas toujours évident. Il est en effet suspecté sur un faisceau d’arguments cliniques et biologiques : amaurose fugace, symptômes systémiques, baisse profonde de l’acuité visuelle, champ visuel très altéré, diplopie, aspect du nerf optique au fond d’œil, présence d’un retard choroïdien à l’angiographie à la fluorescéine ou encore syndrome inflammatoire biologique. Le diagnostic de certitude est posé par l’analyse anatomopathologique d’une biopsie de l’artère temporale, celle-ci ne devant pas retarder la corticothérapie. Cependant, il est fréquent de demander une imagerie IRM injectée, principalement pour rechercher un diagnostic différentiel (neuropathie optique rétrobulbaire (NORB), tumeur orbitaire, Drüse papillaire, atteinte des voies visuelles postérieures) ou des signes de leucopathie microvasculaire cérébrale dans les formes non artéritiques.
L’IRM peut maintenant aider au diagnostic positif des NOIA
Il est reconnu comme contributif de réaliser une IRM à la phase aiguë de la maladie de Horton (dans les 8 premiers jours suivant la mise en route du traitement par corticothérapie). C’est valable que la maladie systémique soit associée ou non à des troubles visuels. Cela permet de rechercher en imagerie une prise de contraste pariétale des branches de l’artère carotide externe qui signe la vascularite. Les performances diagnostiques sont très intéressantes, comme le montre une étude de cohorte multicentrique publiée dans Radiology [3].
Une prise de contraste de la tête du nerf optique
Récemment, nous avons mis en évidence, dans une étude bicentrique, un nouveau signe IRM de diagnostic positif de NOIA, quelle que soit l’étiologie. Il consiste en une prise de contraste de la tête du nerf optique sur une séquence 3D T1 injectée en coupe fine sur le nerf optique, lorsque l’IRM était réalisée dans les premiers jours après la consultation chez l’ophtalmologiste [4]. De façon intéressante, la prise de contraste était constante pour les NOIA liées à une maladie de Horton (15 cas sur 15) et inconstante dans les formes non artéritiques (7 cas sur 15). On peut émettre l’hypothèse d’un œdème cytotoxique plus important dans les formes artéritiques, avec une fragilisation vasculaire responsable de la prise de contraste. L’intérêt principal de ce signe IRM est le repérage des NOIA cliniquement typiques et qui ne présentent pas de prise de contraste de la tête du nerf optique. Il permet, dans cette population, d’affirmer l’absence de maladie de Horton et de réaliser une épargne précoce de corticoïdes. En ajoutant cette nouvelle donnée issue des séquences T1 à l’imagerie vasculaire carotidienne externe, faisable avec le même type de séquence, on devrait pouvoir avoir une performance diagnostique très élevée de l’IRM injectée pour le diagnostic de la maladie de Horton dans les années à venir. Il est important pour le radiologue de bien différencier la prise de contraste de la tête du nerf optique des NOIA de celle des NORB, dont le rehaussement nerveux peut être segmentaire antérieur mais non isolé à la tête du nerf optique.
Les Drüses
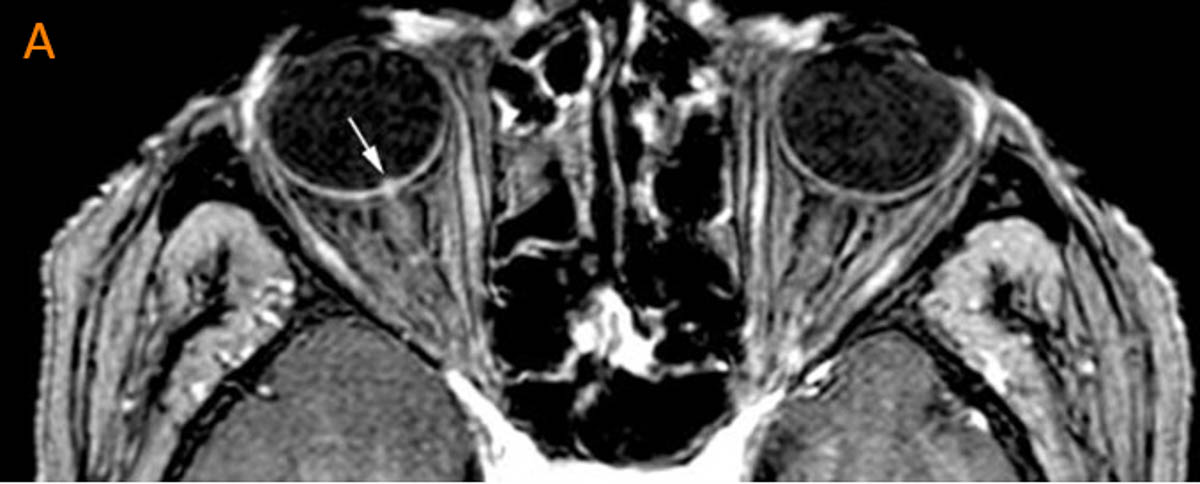
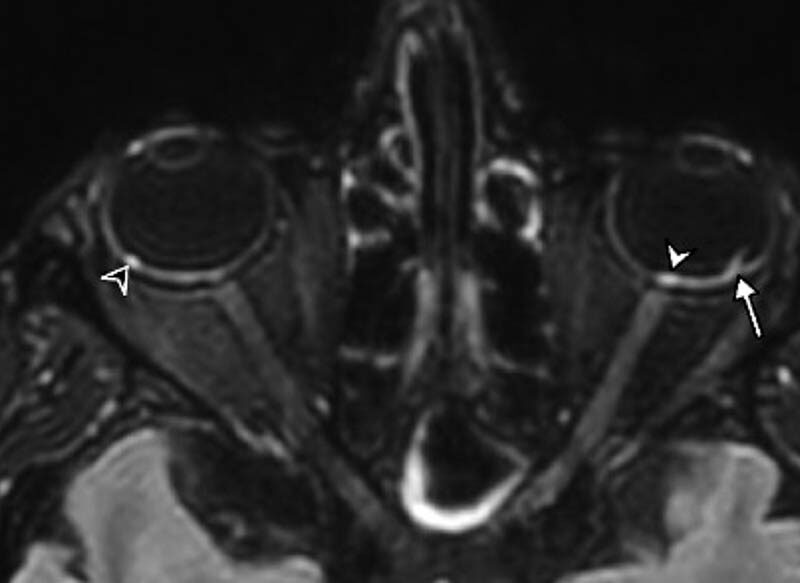
L’étude encéphalique dans les suspicions clinicoradiologiques de NORB vise essentiellement à rechercher des lésions de démyélinisation cérébrale avec des lésions en hypersignal FLAIR de la substance blanche juxtaventriculaire ou juxtacorticale dans le cadre de la sclérose en plaque, voire des lésions diencéphaliques dans la maladie de Devic. On notera enfin que certains patients, typiquement plus jeunes que pour les autres étiologies, présentent des calcifications de la tête du nerf optique appelées Drüses qui, par des phénomènes compressifs locaux, peuvent entraîner un tableau ischémique cliniquement proche de la NOIA. Les Drüses se manifestent en IRM par un asignal T1 témoignant des dépôts calciques au niveau de la tête du nerf optique. La figure 1 compare les aspects IRM classiques de NOIA sur maladie de Horton, NORB antérieure et Drüses papillaire.
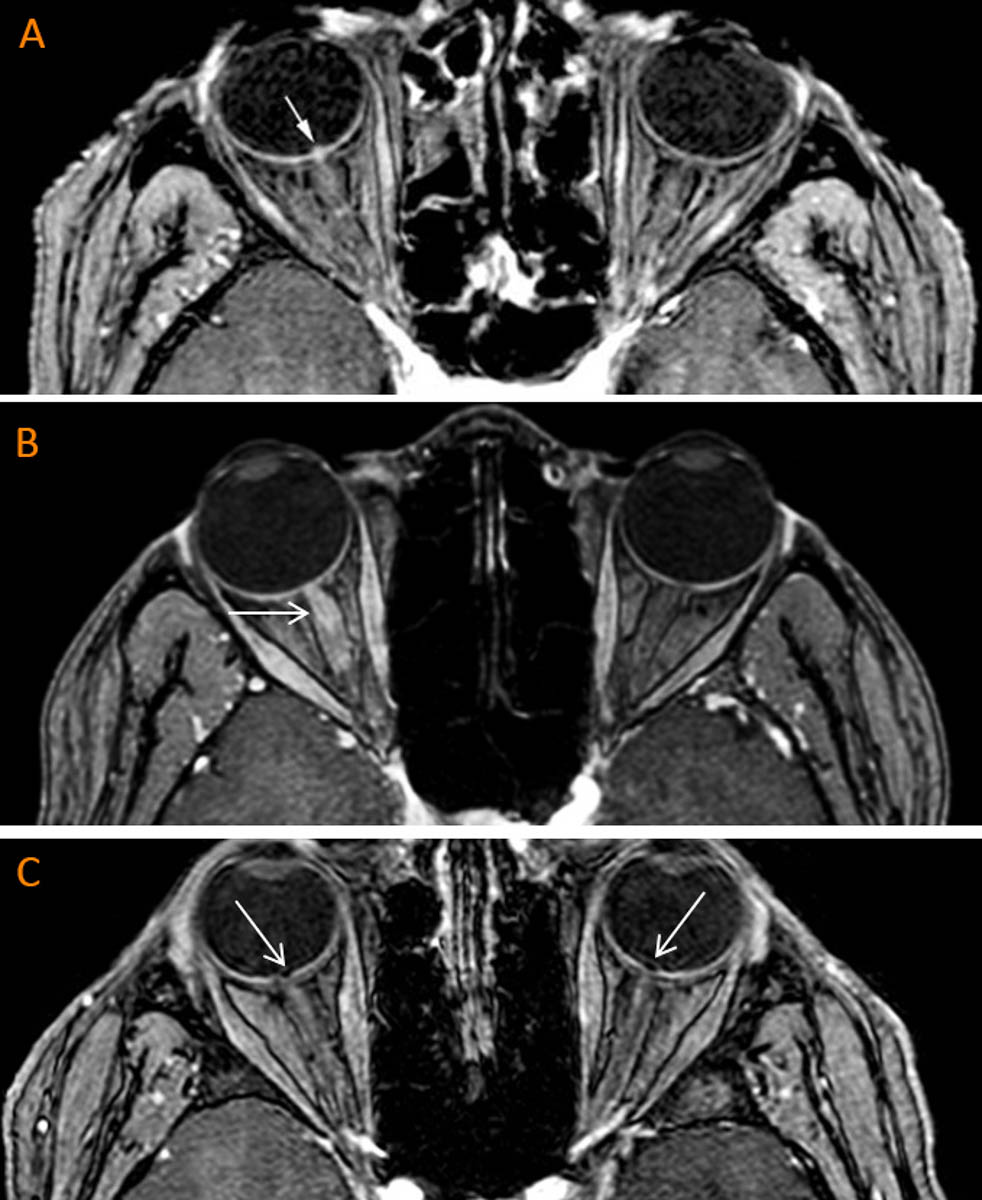
Figure 1. 3 exemples de séquences 3D T1 injectée en écho de gradient avec compensation de flux centrée sur les voies visuelles antérieures. A. Patient avec NOIA de l’œil droit dans un contexte de maladie de Horton. La prise de contraste de la tête du nerf optique droit avec aspect de protrusion (« Central Bright Spot Sign ») est constante dans les NOIA artéritiques, inconstante dans les NOIA non artéritiques. B. Patiente avec NORB droite, ici affectant la partie antérieure du nerf optique (flèche blanche) sans être isolée à la tête du nerf optique. C. Jeune patient avec tableau clinique de NOIA droite, mais dont le diagnostic final retient une ischémie sur Drusen (flèches blanches), qui est bilatérale mais uniquement parlante cliniquement du côté droit. © CHU Grenoble Alpes
Perspectives : diagnostic en IRM de diffusion des atteintes ischémiques rétiniennes
Dans un contexte de recherche clinique, on notera la publication prochaine d’une étude centrée sur l’intérêt de l’imagerie de diffusion avec un post-traitement de type tractographie probabiliste pour mettre en évidence les fibres nerveuses de la neurorétine [5]. L’intérêt est immédiat pour l’exploration des NOIA, puisque la tractographie permet de directement visualiser les couches de la neurorétine ischémiée. Elle offre ainsi une alternative intéressante à la tomographie par cohérence optique (OCT) pour l’analyse des couches de la rétine. Les résultats préliminaires montrent une corrélation entre le déficit du champ visuel des patients avec NOIA (typiquement altitudinal inférieur mais qui peut concerner tous les cadrans) et l’atteinte du faisceau temporal qui relie la tête du nerf optique à la macula.
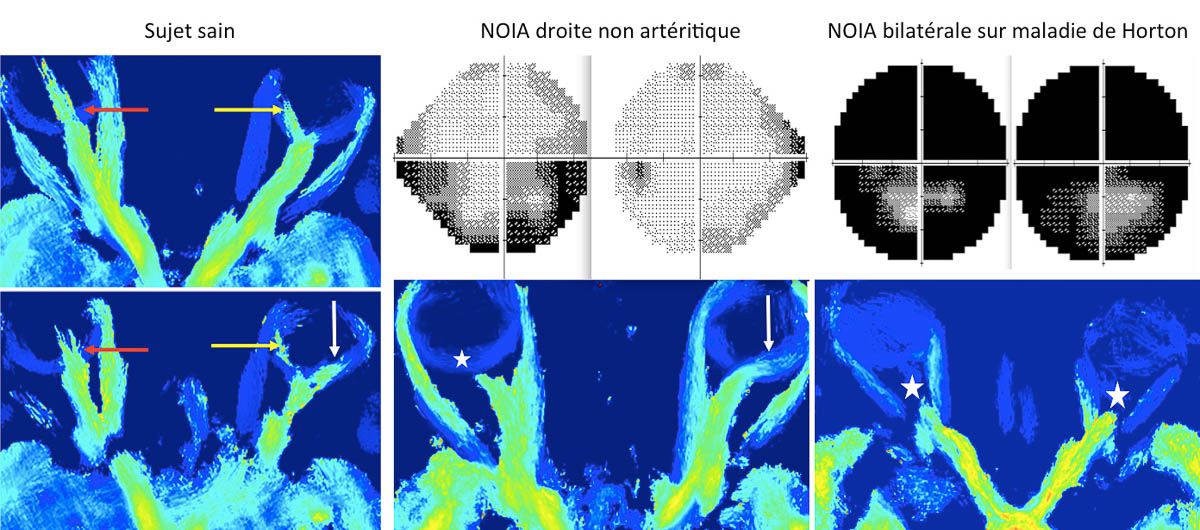
Figure 2. Comparaison entre un sujet sain et deux patients : un avec une NOIA unilatérale et un avec une NOIA bilatérale, ayant bénéficié d’une IRM de tractographie, avec corrélation aux données du champ visuel. Le sujet sain présence une distribution hétérogène des faisceaux de la neurorétine, avec du côté droit un faisceau supérieur (flèche rouge), un faisceau nasal (flèches jaunes) et un faisceau temporal (flèche blanche) au niveau de l’œil gauche. Le premier malade présente une absence complète de faisceau de la neurorétine à droite (étoile blanche) concomitante d’un déficit du champ visuel estimée à -14 dB (Déviation moyenne). De façon intéressante, le faisceau temporal de la neurorétine à gauche est bien visible sur cet œil asymptomatique (déficit minime du champ visuel à -4 dB) mais apparaît moins dense, sachant que ce sont des pathologies à risque de bilatéralisation. Enfin le dernier malade a bilatéralisé sa NOIA en quelques jours sur découverte de maladie de Horton. Il souffre d’un scotome diffus bilatéral du champ visuel, et la séquence de tractographie permet de mettre en évidence un aspect de disparition complète de la partie antérieure et de la neurorétine des 2 nerfs optiques, présumée être secondaire à de la nécrose ischémique sur l’artérite gigantocellulaire. © CHU Grenoble-Alpes
Concrètement, les patients dont il est impossible de visualiser les faisceaux rétiniens en tractographie du côté de la NOIA présentent un devenir clinique plus péjoratif. Le defect de leur champ visuel est plus important à 6 mois que celui des patients dont on peut « tracker » au moins le faisceau temporal de la neurorétine. Cette méthode peut être appliquée également aux occlusions de l’artère centrale de la rétine ou aux glaucomes chroniques pour imager la perte axonale.
Le manipulateur pour limiter les artefacts de mouvement
Ce type de post-traitement en imagerie est théoriquement faisable avec des imageurs IRM récents, 1,5 T comme 3 T, mais nécessite une séquence de diffusion avec au moins 32 directions. Il faut aussi un logiciel dédié avec un algorithme probabiliste de reconstruction des faisceaux de fibres. On insiste également sur le rôle du manipulateur en imagerie ophtalmologique pour limiter les artefacts de mouvements. Il est crucial pour l’imagerie de diffusion. Classiquement, on demande aux patients de garder un point de fixation oculaire pendant la séquence, soit en traçant une croix sur le toit de l’aimant, soit en mettant un miroir sur l’antenne tête, avec comme consigne au patient de fixer un écran situé derrière l’IRM, ou ses pieds en l’absence d’installation dédiée (figure 3). L’IRM de diffusion, sans injection de produit de contraste, est promise à un bel avenir pour la pathologie des voies visuelles antérieures.
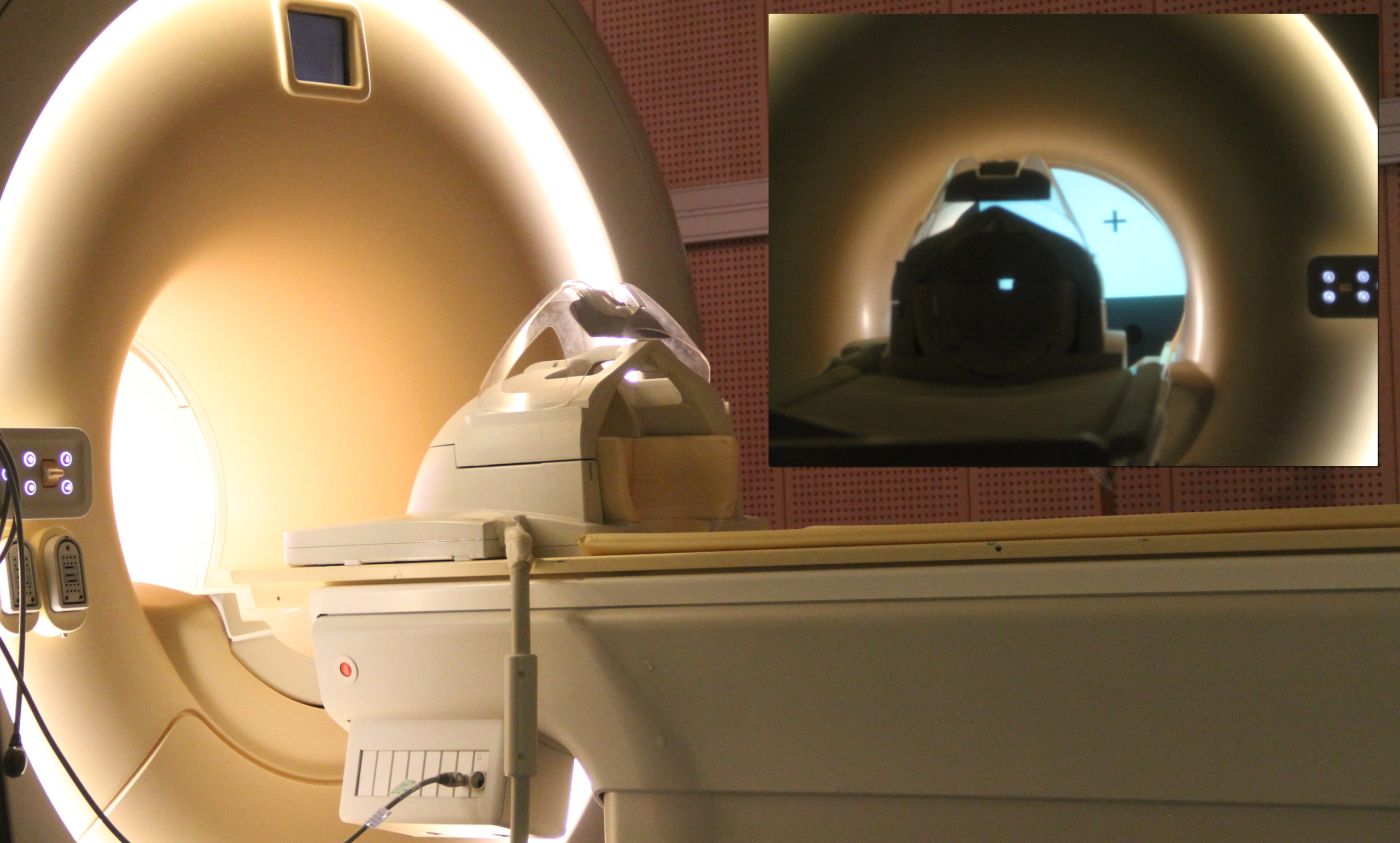
Figure 3. Classiquement, on demande aux patients de garder un point de fixation oculaire pendant la séquence, soit en traçant une croix sur le toit de l’aimant, soit en mettant un miroir sur l’antenne tête, avec comme consigne au patient de fixer un écran situé derrière l’IRM, ou ses pieds en l’absence d’installation dédiée. © Johan Pietras







Discussion
Aucun commentaire
Commenter cet article