Les myomes utérins : pathologies fréquentes, thérapeutiques nombreuses
Définition
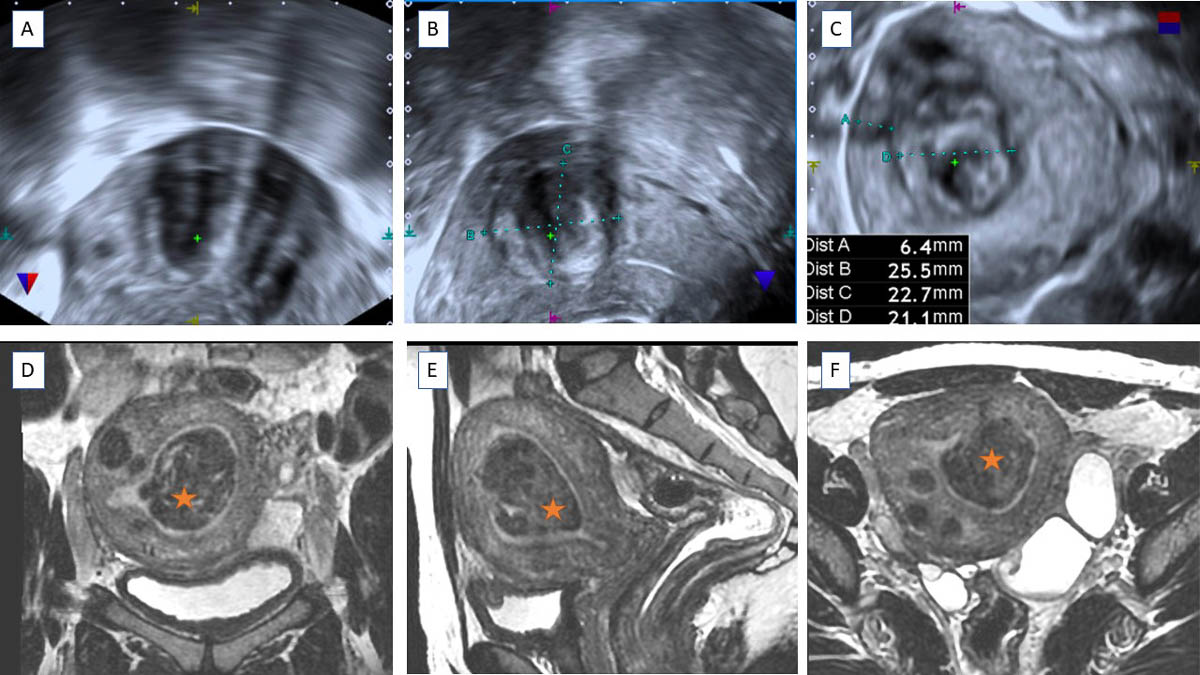
Le myome utérin est une pathologie bénigne très fréquente chez la femme en âge de procréer, touchant jusqu’à ¾ des femmes de plus de 50 ans [1]. Il s’agit d’une tumeur bénigne développée aux dépens du myomètre. Sa présence est suspectée devant des ménorragies, une augmentation du périmètre abdominal ou une pesanteur pelvienne [2]. En fonction de sa localisation, il peut également être responsable de symptômes en rapport à la compression d'organes adjacents tels que la pollakiurie, les douleurs rectales à la défécation ou des troubles digestifs. Souvent, les myomes utérins sont découverts de manière fortuite lors d'un examen pelvien gynécologique, une échographie mais aussi en imagerie en coupes lors de la réalisation d’un scanner abdominopelvien ou d’une imagerie par résonance magnétique (IRM) explorant le pelvis. Leur nombre et leur taille sont très variables, pouvant atteindre plusieurs dizaines de ce







Discussion
Aucun commentaire
Commenter cet article