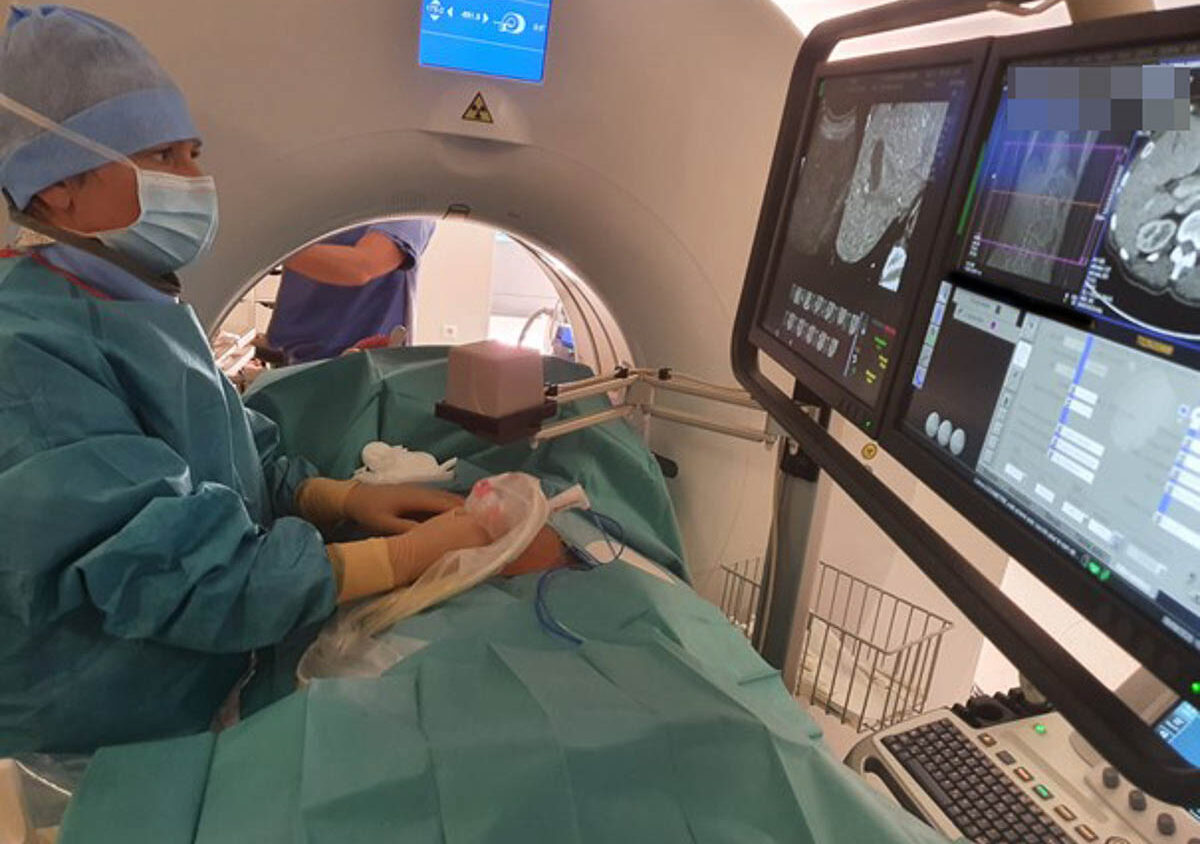
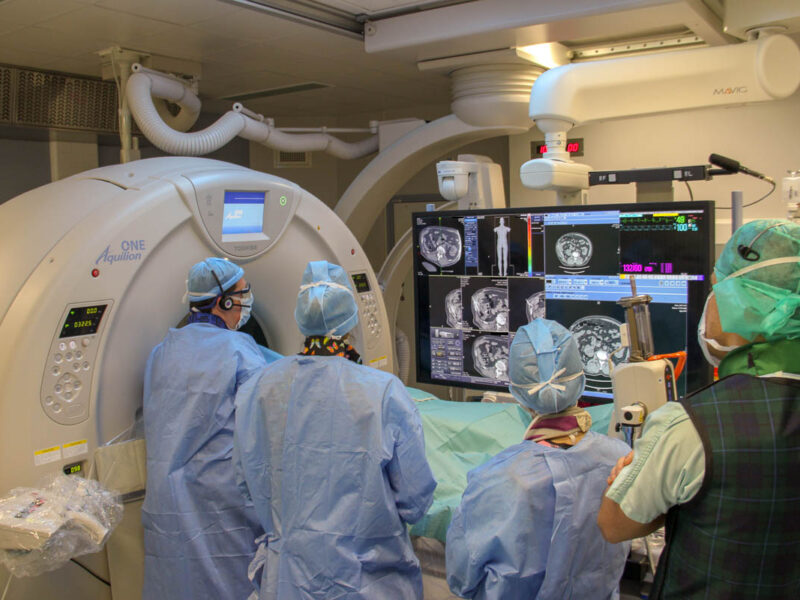
Le principe de la radiofréquence
La radiofréquence est une méthode de destruction physique thermique utilisant un courant sinusoïdal produit par un générateur de 375 à 500 kHz. Les régions traversées par ce courant subissent une agitation ionique qui induit, par friction entre les particules, un échauffement tissulaire. L’ADN des cellules tumorales est lésé à une température entre 50 et 60 °C, avec une dénaturation protéique irréversible et une mort des cellules. Une carbonisation des tissus apparaît à 100 °C, augmentant la résistance électrique et altérant les possibilités de diffusion du courant de radiofréquence. C’est pour cette raison que les électrodes sont refroidies, limitant l’accumulation de chaleur au contact de l’aiguille. Il existe plusieurs systèmes proposés par les industriels, qui adaptent le temps de traitement et l’intensité de courant délivré, soit en monitorant la température, soit en monitorant les variations de résistance tissulaire entre l’électrode et les plaqu















Discussion
Aucun commentaire
Commenter cet article