Introduction
Décembre 2019 fut marqué par la découverte d’un nouveau coronavirus, le SARS-CoV-2 (Severe Acute Respiratory Syndrome CoronaVirus-2) responsable d’une série de cas de pneumonie virale à Wuhan, en Chine. Il s’est rapidement propagé à travers le monde sous la forme d’une maladie dénommée COVID-19 (COronaVIrus Disease 2019) par l’Organisation mondiale de la santé (OMS) [1]. Sa contagiosité est telle que l’épidémie est devenue une « urgence de santé internationale » fin janvier 2020 [2, 3]. Le 14 mai 2020, plus de 300 000 décès étaient recensés dans le monde dont 27 425 en France [4].
La présentation clinique la plus typique du COVID-19 est celle d’une infection respiratoire basse fébrile avec toux sèche, dyspnée, fatigue et myalgies. Environ 15 à 20 % des cas sont graves et 2 à 3 % sont mortels [3, 5, 6].
Un diagnostic précoce de la maladie permettant l’isolement des sujets infectés est à ce jour le moyen le plus efficace de limiter la propagation du virus. La recherche en laboratoire d’ARN viral par RT-PCR (reverse transcriptase – polymerase chain reaction) à partir d’écouvillonnages nasopharyngés est la méthode diagnostique de référence. Cependant, l’obtention des résultats demande plusieurs heures, avec une sensibilité imparfaite (60 à 70 %) car dépendante de la qualité du prélèvement et du taux de réplication virale au sein des voies aériennes supérieures [7 – 9]. Dès lors, face au flux de patients arrivant à l’hôpital, le scanner thoracique s’est imposé comme un outil diagnostique rapide et efficace, compte tenu de son accessibilité et de la présentation souvent assez caractéristique des lésions de COVID-19 [10]. Le radiologue est donc devenu un acteur essentiel dans la prise en charge des patients suspects de COVID-19.
Indications et place du scanner thoracique dans la prise en charge des patients suspects de COVID-19
Afin de limiter la propagation du virus en leur sein, les institutions hospitalières ont rapidement mis en place des filières spécifiques « COVID » et « non COVID », avec un triage des patients dès leur accueil aux services des urgences [11].
Un scanner thoracique sans injection de produit de contraste est indiqué pour des symptômes à type de dyspnée ou polypnée mal tolérée nécessitant une prise en charge hospitalière, afin d’orienter les patients dans la filière adéquate en anticipation des résultats du test RT-PCR [12]. La très bonne sensibilité (> 90%) du scanner pour le diagnostic de COVID-19 permet, en l’absence d’anomalie parenchymateuse, d’orienter les patients en secteur « non COVID ». Les rares faux négatifs (scanners normaux alors que la maladie est présente) correspondent généralement à des patients symptomatiques depuis moins de 3 jours. La spécificité du scanner est plus variable (25 % à 80 % selon les études). Lorsqu’il y a des anomalies parenchymateuses, le radiologue doit statuer sur leur caractère soit très évocateur, soit indéterminé, soit non évocateur, ce qui aura un impact direct sur le secteur d’hospitalisation (figure 1).
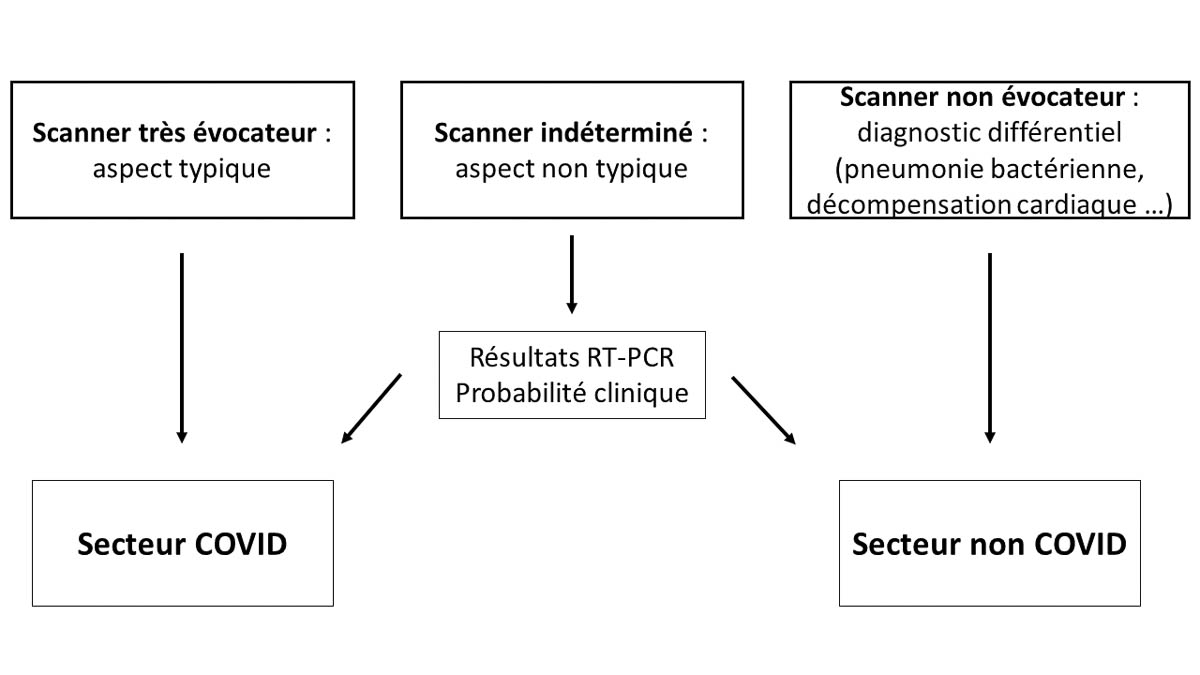
Figure 1. Algorithme simplifié de prise en charge des patients suspects de COVID-19 en fonction des résultats du scanner thoracique. © L. T., L. M.
La Société d’imagerie thoracique (SIT) ne recommande pas la réalisation d’une radiographie du thorax ni d’une échographie pour une suspicion de COVID-19. Le scanner thoracique n’est pas indiqué pour le dépistage du COVID-19. Après la première vague de l’épidémie, ces recommandations sur les indications de scanner thoracique ne sont pas significativement modifiées.
Tableau scanographique typique
Les anomalies scanographiques les plus évocatrices de la pneumonie COVID-19 sont des plages en verre dépoli (environ 80 % des cas), multifocales, bilatérales, asymétriques. Les régions périphériques, postérieures et basales sont généralement les plus touchées [13 – 16] (figure 2).
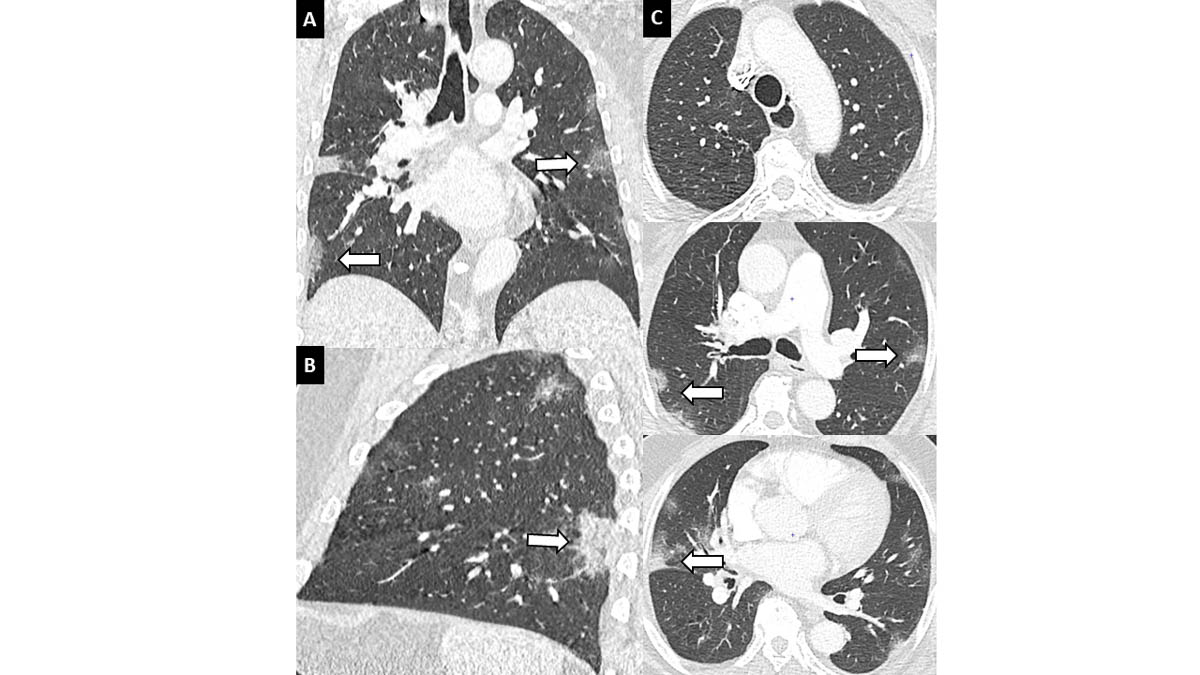
Figure 2. Présentation scanographique typique de pneumonie COVID-19 chez un patient de 50 ans. Scanner thoracique en coupes coronale (A), sagittale (B) et axiales (C). Plages de verre dépoli (flèches) bilatérales, sous-pleurales, prédominant dans les bases. © L. T., L. M.
Ces opacités en verre dépoli ont tendance à progresser au cours du temps pour donner classiquement un aspect dit de « crazy paving » (superposition de verre dépoli et de réticulations intralobulaires) et/ou de condensations parenchymateuses plus ou moins rétractiles [13, 15, 17, 18] (figure 3).
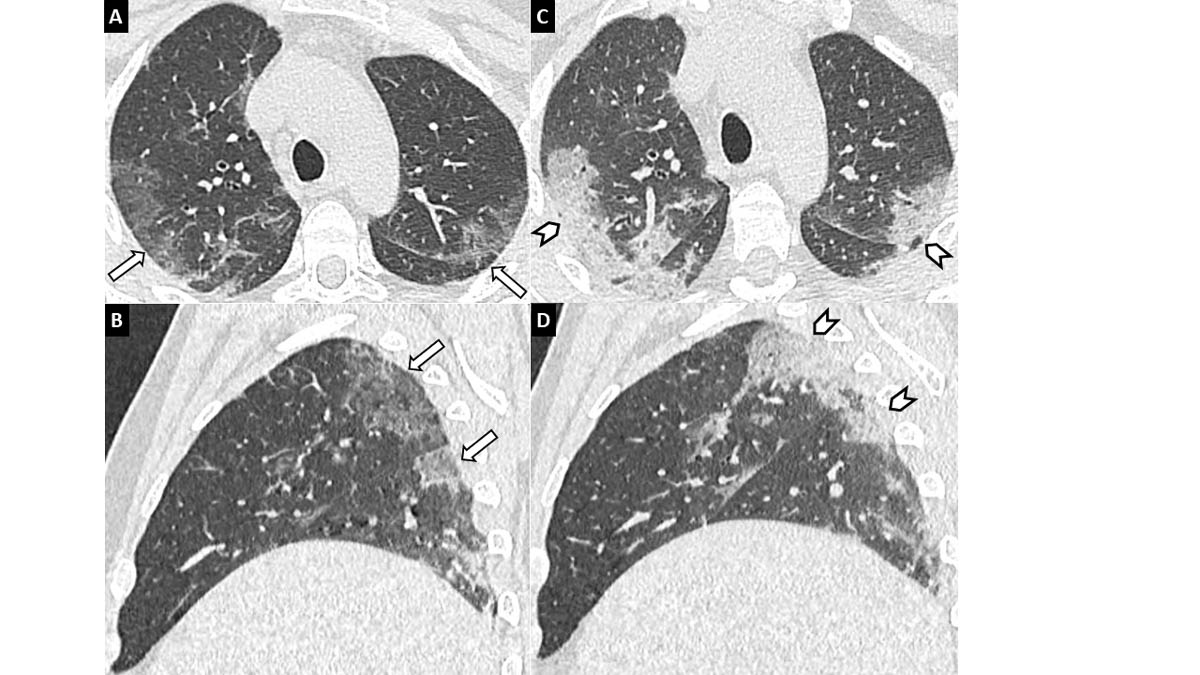
Figure 3. Évolution des lésions scanographiques de pneumonie COVID-19 chez une femme de 65 ans. Scanner thoracique sans injection réalisé au début des symptômes (A, B) et après une semaine d’évolution (C, D). Initialement caractérisées par du verre dépoli (flèches), les zones pathologiques se densifient avec l’apparition de plages de condensation discrètement réticulées (têtes de flèche). © L. T., L. M.
La découverte fortuite d’anomalies évocatrices de COVID-19 chez des patients infectés asymptomatiques est possible. Cependant, l’atteinte scanographique est généralement moins sévère [19, 20].
Les signes non évocateurs de COVID-19 sont un syndrome micronodulaire, une excavation, des lignes septales et des adénomégalies médiastinales, qui correspondent généralement à des diagnostics différentiels (bronchiolites, pneumopathies bactériennes, insuffisance cardiaque).
L’atteinte parenchymateuse est maximale entre J8 et J14. Elle est suivie le plus souvent d’une diminution progressive en taille et en densité des opacités parenchymateuses à partir de J14. [15, 21].
Les données manquent encore sur l’aspect du parenchyme à distance de l’infection. Il semble que la guérison totale du poumon puisse être observée au bout d’un mois environ [15, 18]. Mais de nombreux patients, notamment ceux avec des formes initialement graves, présentent toujours des images linéaires plus ou moins rétractiles (figure 4). On redoute donc des séquelles fibrosantes en nombre, même si on ignore encore à ce stade dans quelle proportion [22].
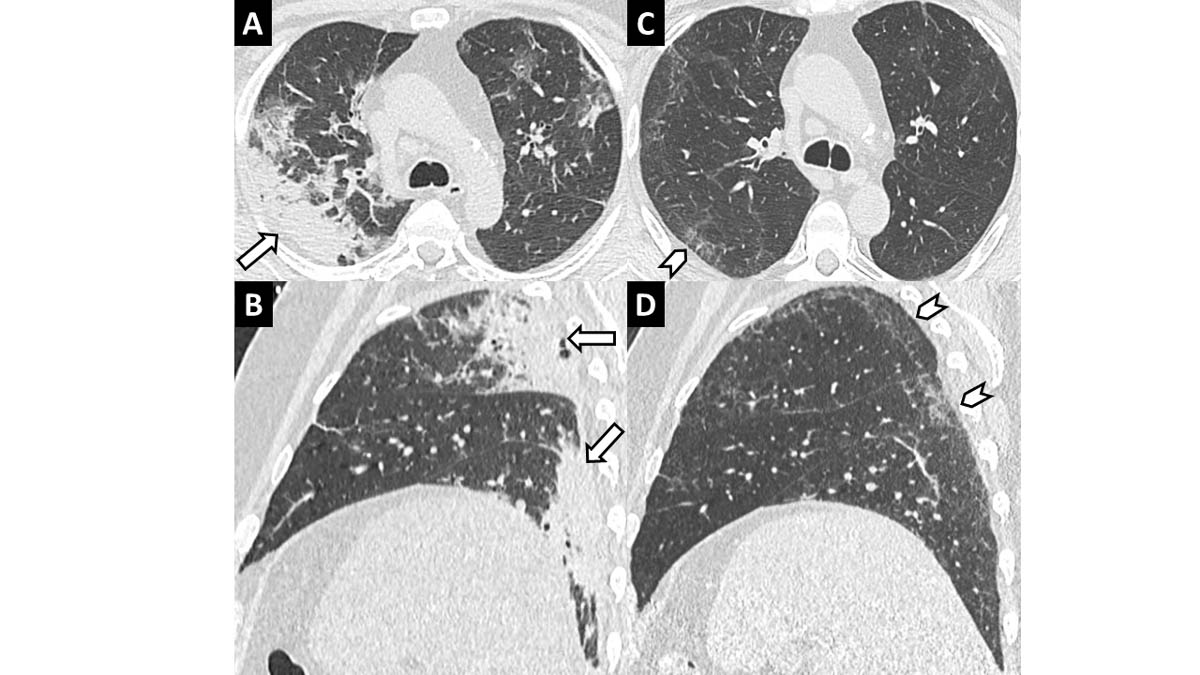
Figure 4. Evolution à distance d’une pneumonie COVID-19 chez un patient de 59 ans. Scanner thoracique sans injection réalisé une semaine après le début des symptômes (A, B) et un mois après la sortie d’hospitalisation (C, D). Le suivi démontre une régression des condensations périphériques postérieures prédominant à droite (flèches) pour laisser place à de fines réticulations (têtes de flèche). © L. T., L. M.
Formes inhabituelles
Un pattern de pneumonie organisée peut être observé dans près de 10 % des cas, sous forme de condensations arciformes ou pseudonodulaires, parfois accompagnées d’un signe du halo inversé.
Des présentations unilatérales sont possibles dans 20 à 30 % des cas environ, en général à un stade précoce avant que les lésions ne se bilatéralisent [9, 23, 24].
Des atteintes à prédominance péribronchovasculaire ou parfois apicale ont également été décrites [16, 25].
Enfin, lorsque l’infection survient sur un poumon remanié (ex : emphysème, fibrose), la présentation scanographique de la pneumonie COVID-19 devient beaucoup moins spécifique et rend indispensable une comparaison rigoureuse avec les examens antérieurs.
Signes de gravité
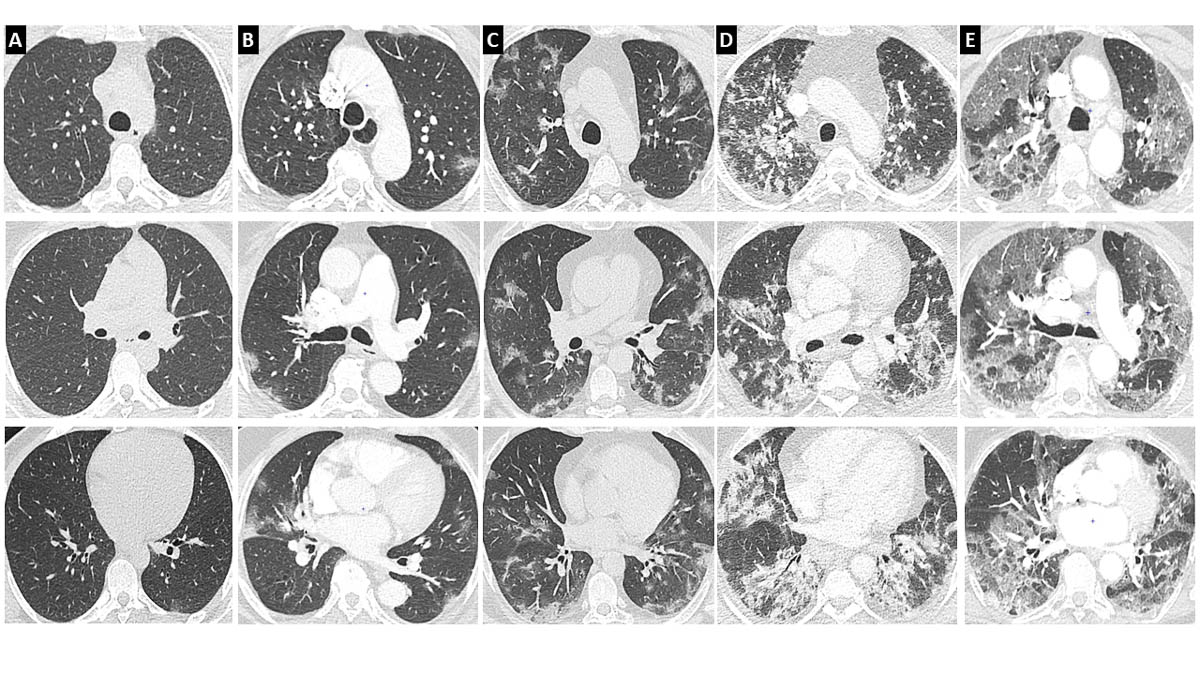
L’étendue et la densité de l’atteinte parenchymateuse sur le scanner initial sont des marqueurs de gravité et sont corrélées à la sévérité clinique [17, 26]. La SIT recommande ainsi de grader l’atteinte parenchymateuse selon une classification visuelle en 5 stades, basée sur le pourcentage de poumon lésé : atteinte absente ou minime (< 10 %), modérée (10 – 25 %), étendue (25 – 50 %), sévère (50 – 75 %) ou critique (> 75 %) [28] (figure 5).
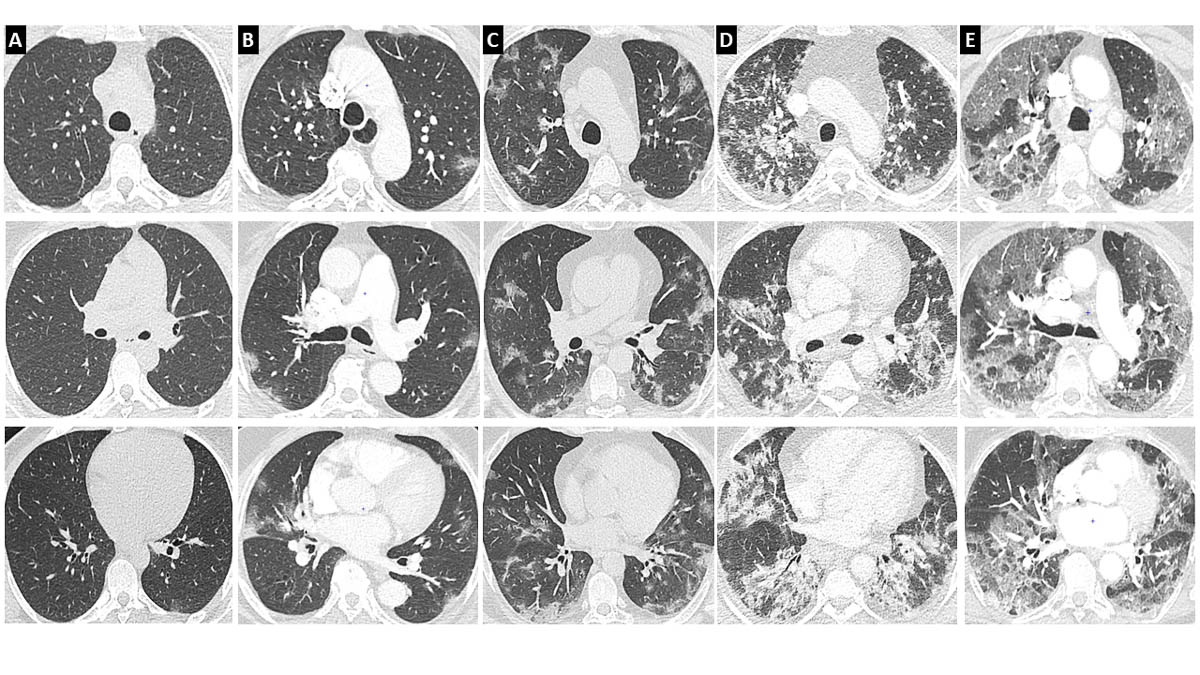
Figure 5. Différents degrés d’atteinte de pneumonie COVID-19. L’atteinte pulmonaire est évaluée visuellement et correspond au ratio du poumon pathologique sur le poumon sain. Elle peut être classée comme minime <10% (A), modérée 10-25% (B), étendue 25-50% (C), sévère 50-75% (D) ou critique >75% (E). © L. T., L. M.
Entre 15 % et 30 % des patients hospitalisés évoluent vers un syndrome de détresse respiratoire aiguë (SDRA), principale cause de mortalité, qui se caractérise au scanner par des condensations parenchymateuses bilatérales déclives [6, 27]. Un épanchement pleural ainsi qu’une distorsion architecturale précoce, avec des bronchectasies de traction seraient aussi des marqueurs de sévérité [22].
Complications
L’évolution des pneumonies à SARS-CoV-2 peut être marquée par la survenue de plusieurs complications. Une surinfection bactérienne pulmonaire sera suspectée en cas d’apparition d’une condensation alvéolaire unilatérale associée à des adénopathies et/ou épanchements pleuraux [22]. Les surinfections aspergillaires pourraient être assez fréquentes chez les patients de réanimation en SDRA [28] (figure 6).
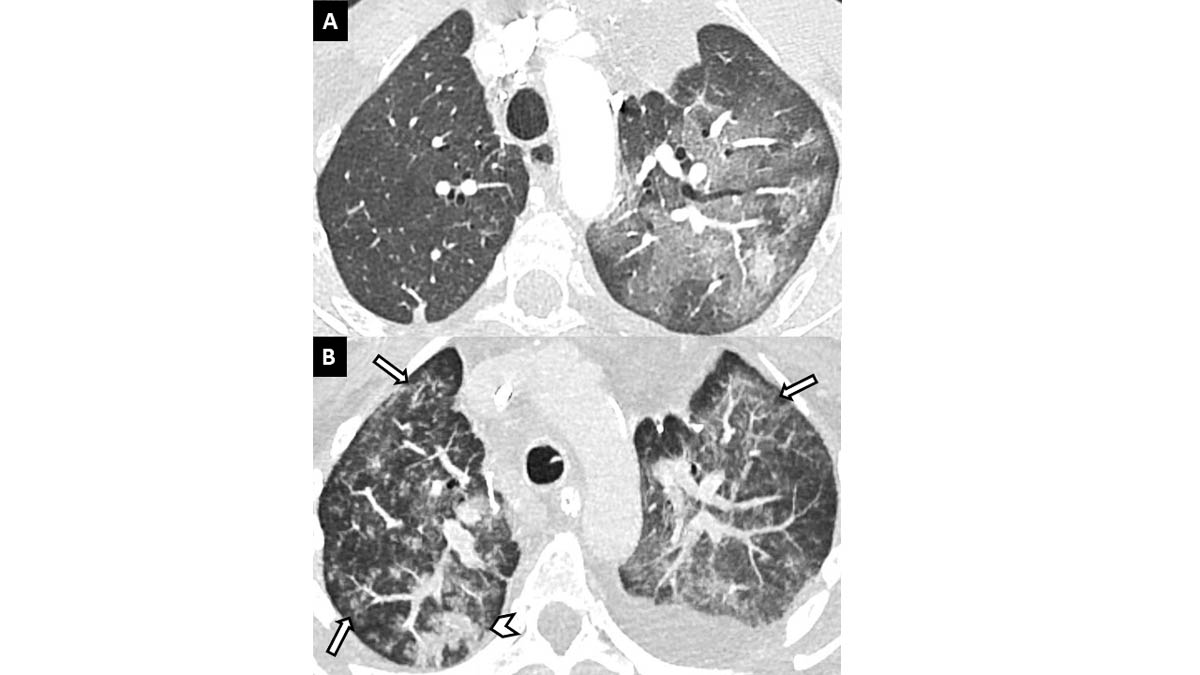
Figure 6. Surinfection aspergillaire chez une patiente ayant présenté un SDRA sur pneumonie COVID-19. Scanner thoracique en coupe axiale réalisé à son entrée en réanimation (A) et une semaine après son admission en reformatage Maximal Intensity Projection (MIP) (B). L’apparition des micronodules en « arbre en bourgeons » (flèches) et de condensations (tête de flèche) dans les lobes supérieurs est en faveur d’une surinfection (dans ce cas aspergillaire, confirmée par l’examen mycologique). © L. T., L. M.
Plusieurs études ont récemment rapporté la survenue plus fréquente d’événements thromboemboliques, notamment d’embolies pulmonaires, dans les formes graves de pneumonies COVID-19. Ces embolies sont liées à un état d’hypercoagulabilité (dont témoigne un taux souvent très élevé de D-dimères), consécutif à une tempête inflammatoire systémique qui survient chez certains patients [29 – 31].
Cependant, l’injection systématique à la recherche d’une embolie pulmonaire n’est à ce jour pas indiquée dans le bilan scanographique initial. Seule une discordance clinicoradiologique (dyspnée et hypoxémie non expliquées par les anomalies parenchymateuses) ou une aggravation respiratoire chez un patient COVID-19 connu doivent conduire à réaliser un scanner injecté (figure 7).
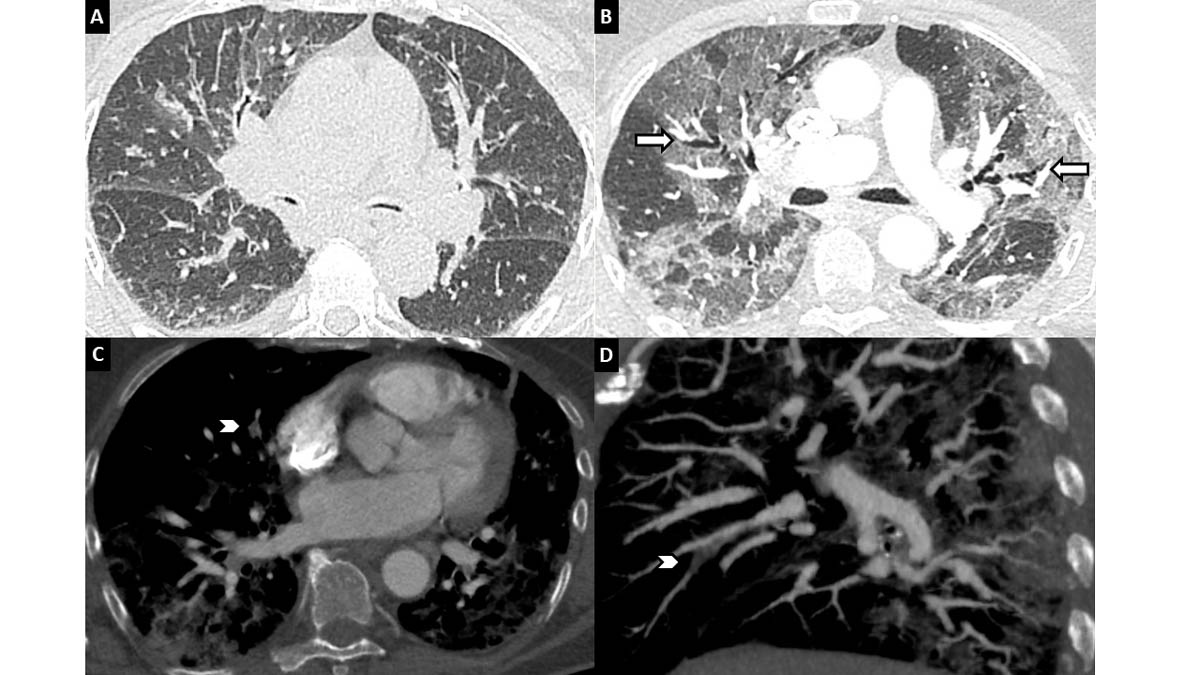
Figure 7. Pneumonie COVID-19 compliquée d’une embolie pulmonaire chez une patiente de 80 ans. Scanner thoracique réalisé sans injection au début des symptômes (A) et avec injection lors de l’épisode de dégradation respiratoire (B, C, D). La coupe axiale (B) démontre une nette majoration de l’étendue des opacités en verre dépoli avec une distorsion architecturale débutante caractérisée par des bronchectasies de traction (flèches). L’angioscanner thoracique en coupe axiale (C) et sagittale reformatée en MIP (D), démontre un thrombus partiellement occlusif au sein de la branche artérielle segmentaire lobaire moyenne médiale (têtes de flèches). © L. T., L. M.
Diagnostics différentiels
Le scanner thoracique étant devenu la pierre angulaire de la prise en charge des dyspnées aiguës dans ce contexte épidémique, il peut être utile de rappeler l’aspect scanographique des principaux diagnostics différentiels.
Diagnostics différentiels fréquents
Par argument de fréquence, les pneumonies lobaires bactériennes, bronchiolites infectieuses et œdèmes pulmonaires cardiogéniques sont les plus souvent retrouvés. Les pneumonies bactériennes sont le plus souvent unilatérales, systématisées à un lobe. Les bronchiolites se caractérisent par des micronodules centrolobulaires et des aspects « d’arbre en bourgeons ». Un œdème cardiogénique se traduit classiquement par un épanchement pleural bilatéral, des lignes septales, un épaississement péribronchovasculaire et du verre dépoli périhilaire.
Autres diagnostics différentiels
Devant du verre dépoli bilatéral et diffus chez un patient immunodéprimé, une pneumocystose devra être évoquée.
Des condensations pulmonaires triangulaires à base pleurale, de densité mixte avec parfois un centre nécrotique, doivent faire suspecter des infarctus pulmonaires et conduire à la réalisation d’un angioscanner thoracique afin de rechercher une embolie pulmonaire (figure 8) [6].
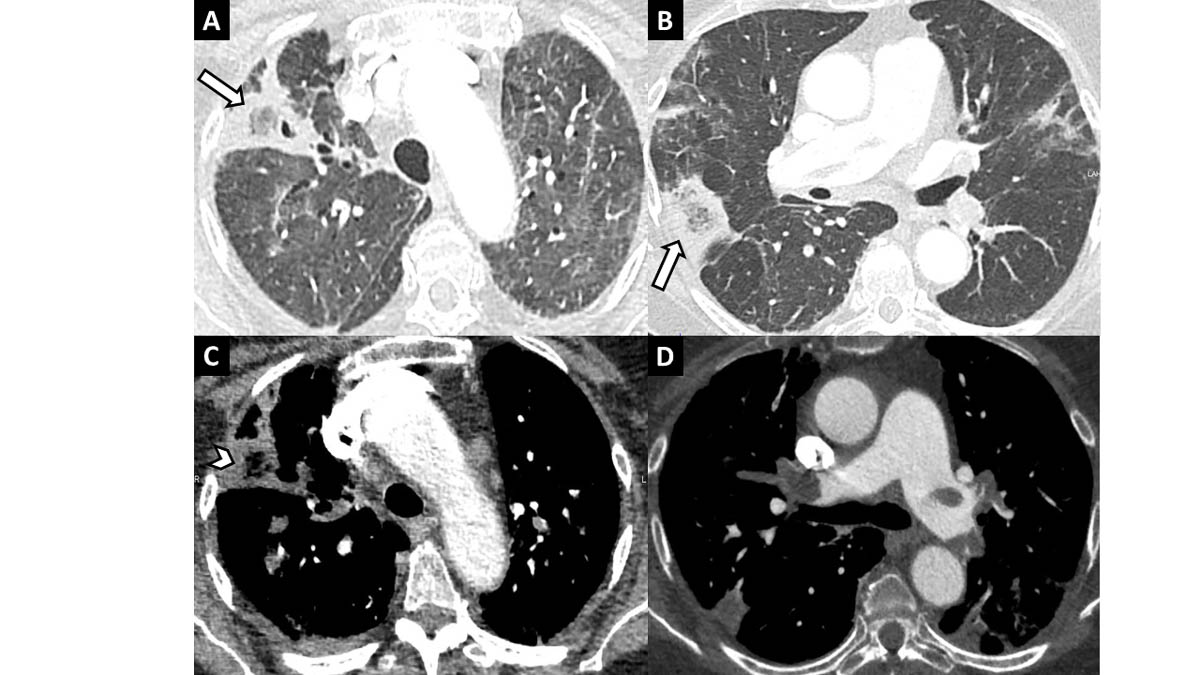
Figure 8. Infarctus pulmonaires chez une femme de 74 ans suspecte de pneumonie COVID-19 avec majoration des D-dimères. Le scanner réalisé avec injection montre des condensations périphériques triangulaires à base pleurale (A, B) (flèches) avec des clartés gazeuses (C) (tête de flèche) caractéristiques d’infarctus pulmonaires dans ce contexte d’embolie pulmonaire proximale bilatérale (D). © L. T., L. M.
Un aspect de pneumonie organisée est compatible avec un COVID-19, mais doit aussi faire évoquer les autres causes rencontrées hors contexte épidémique (médicamenteuse, post-radique, connectivites, etc.) [16]. Enfin, l’existence d’anomalies parenchymateuses sur les examens antérieurs notamment réalisés lors de suivi oncologique, permettra d’évoquer une autre étiologie que le COVID-19.
Perspectives de l’intelligence artificielle
Le développement des techniques d’intelligence artificielle (IA) et d’apprentissage machine en imagerie médicale a été spectaculaire ces dernières années. Ces techniques permettent probablement d’augmenter les performances du radiologue dans le diagnostic de la pneumonie COVID-19 [32].
Le champ d’application de l’IA dans la pneumonie COVID-19 concerne à la fois le diagnostic positif, la quantification automatique de l’extension lésionnelle et l’identification d’éventuels biomarqueurs d’imagerie qui pourraient avoir un intérêt pronostique. Pour l’heure, les principaux articles publiés ont démontré les performances d’algorithmes de deep learning dans la distinction des pneumonies COVID des pneumonies non COVID et dans la quantification de l’extension lésionnelle dans le bilan initial. La quantification reproductible de l’étendue des lésions pourrait s’avérer précieuse pour le suivi longitudinal des patients [33, 34].











Discussion
Aucun commentaire
Commenter cet article