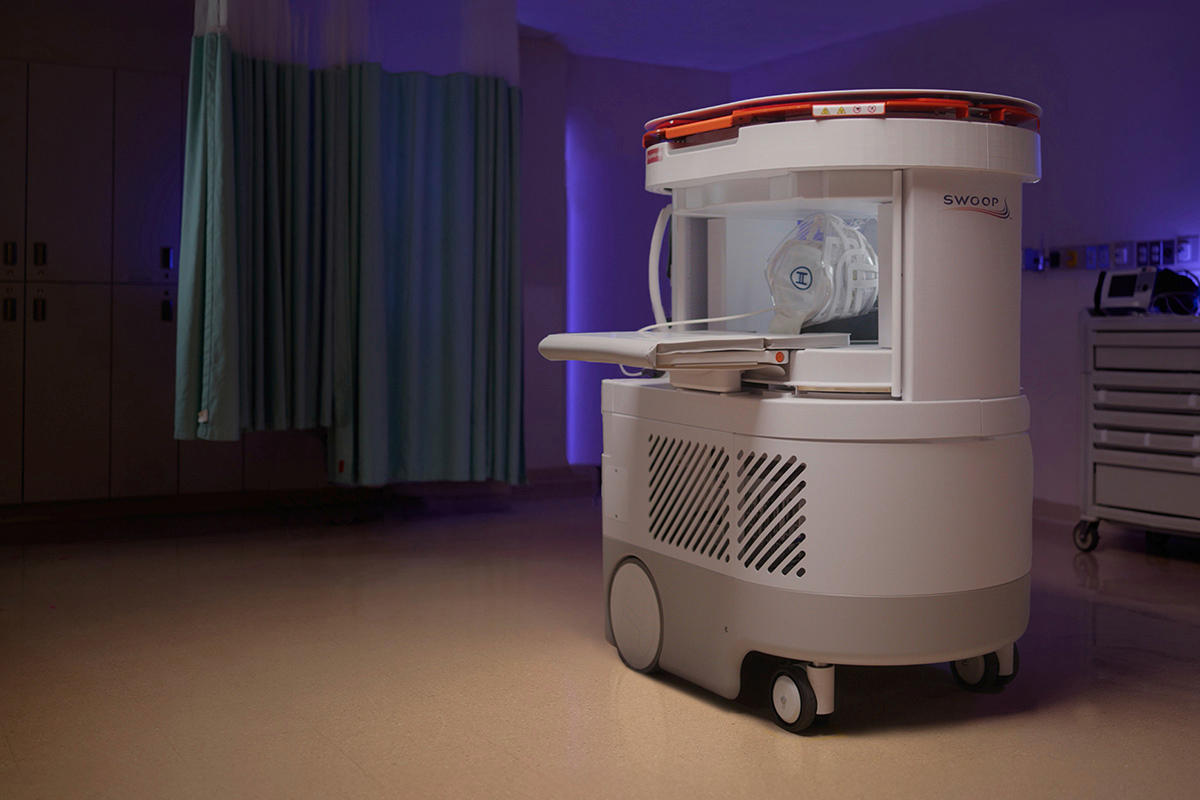
Serait-ce un pas de plus vers la démocratisation clinique de l’IRM ultra-bas champ ? Le 2 juin 2025, la firme étasunienne Hyperfine a publié un communiqué de presse annonçant l’autorisation par la Food and drug administration américaine (FDA) de la nouvelle génération de Swoop®, son IRM cérébrale mobile à ultra-bas champ de 64 mT. Selon l’entreprise, cette autorisation inclut « une IRM mobile complètement neuve, utilisant le software propriétaire Optive AI® » – un logiciel dont Hyperfine avait annoncé l’autorisation FDA dans un autre communiqué le 28 mai.
Design « centré sur le patient »
L’entreprise affirme dans son communiqué avoir retravaillé Swoop® grâce à son expérience de cinq ans de déploiement en vie réelle sur les sept continents, lui apportant « des améliorations de software et de hardware critiques à son utilité clinique ». Côté hardware d’abord, la nouvelle génération d’IRM présente « des innovations spécialement conçues pour fournir le meilleur rapport signal sur bruit », ai












Discussion
Aucun commentaire
Commenter cet article