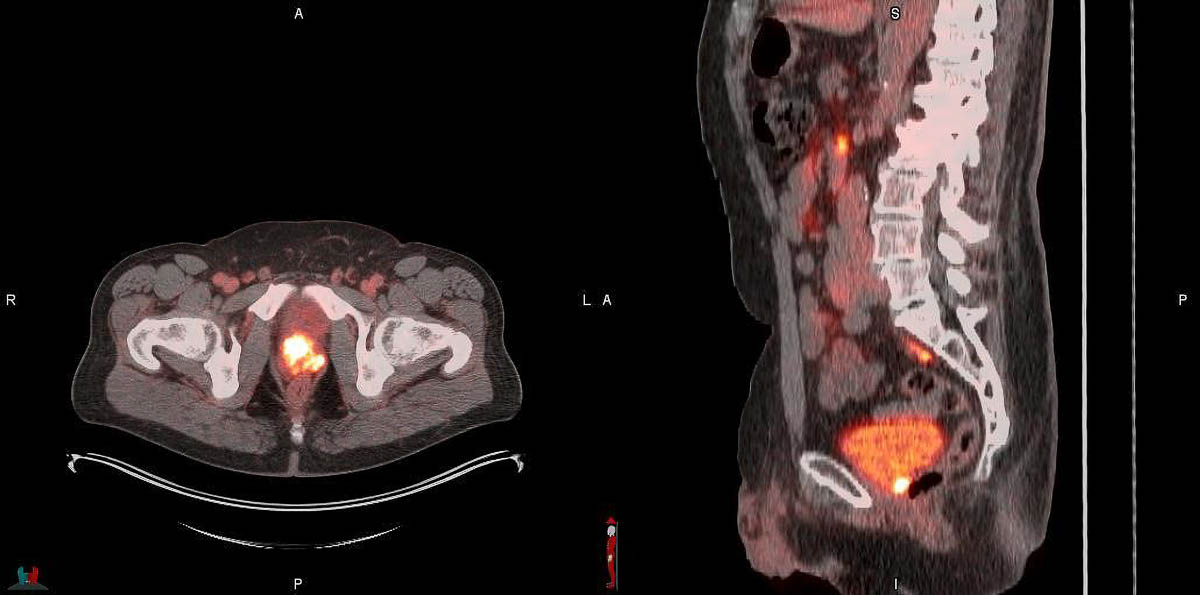
Et de trois ! Après l'approbation du 68Ga-PSMA-11 le 1er décembre 2020 et celle du 18F-DCFPyL ou 18F-piflufolastat (Pylarify®, Progenics Pharmaceuticals) le 26 mai 2021, la Food and drug administration (FDA) vient d'approuver le 25 mai le 18F-rhPSMA-7.3 ou 18F-flotufolastat (POSLUMA®, Blue Earth Diagnostics), un troisième radiopharmaceutique diagnostique pour la TEP ciblant l’antigène membranaire spécifique de la prostate (PSMA) en moins de 3 ans. L'origine de cette ruée vers les ligands spécifiques du PSMA ? Leur signature prostatique très spécifique. Exprimée environ 100 fois plus dans la prostate que dans les autres organes chez le sujet sain, la protéine membranaire PSMA est un bon marqueur des tumeurs primitives de la prostate et de leurs métastases – de même que les radiotraceurs qui s'y lient spécifiquement.
Des discussions en cours avec les autorités anglaises et européennes
Le nouveau médicament est disponible commercialement depuis début juin aux États-Unis. Il permet le diagno













Discussion
Aucun commentaire
Commenter cet article